Попеременное окисление
Cтраница 3
На первых этапах развития производства синтетического аммиака необходимый для этого процесса водород в ряде стран получали громоздким железо-паровым методом, разработанным Лавуазье еще в 1783 г. Данный метод, основанный на попеременном окислении закиси железа FeO парами воды до закиси-окиси железа Fe3O4 и восстановлении последней водяным газом снова до FeO, был малопроизводителен и связан с огромными затратами тепла. [31]
В литературе механизмы каталитических окислительно-восстановительных реакций разделены на две группы [14]: реакции, протекающие с образованием промежуточного комплекса между катализатором и обоими реагентами ( окислитель и восстановитель) без изменения степени окисления катализатора; реакции, включающие попеременное окисление и восстановление катализатора. [32]
Таким образом, соответствие формы зависимости Сре V - l от СН202 1 при разных Cs виду уравнения ( 1) и соответствие полученной к3 литературным данным позволяет сделать заключение о том, что механизм реакции окисления о-аминофе-нола пероксидом водорода, катализируемой Fe3, связан, по-видимому, с попеременным окислением и восстановлением катализатора. [33]
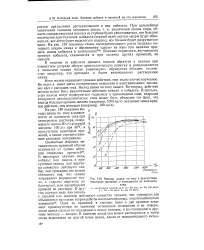 |
Выходы цинка по току в присутствии. [34] |
Ионы железа оказывают сложное действие, еще недостаточно изученное. Во-первых, имеет место попеременное окисление и восстановление; последнее идет с расходом тока. Выход цинка по току падает. Во-вторых, действие железа может быть аналогичным действию никеля и кобальта. [35]
Пероксид водорода впоследствии разлагается на воду и кислород в результате действия другого фермента - каталазы. Следовательно, работа супероксиддисмутазы заключается в попеременном окислении и восстановлении иона меди, связанного с белком. Роль ионов цинка, по-видимому, сводится к повышению устойчивости фермента. [36]
Активация всегда сопровождается увеличением поверхности адсорбента. Наиболее общим методом активации металлических катализаторов являются попеременное окисление и восстановление. Мы видели, что восстановление увеличивает поверхность катализатора Fe804 примерно в 100 раз. В то время как попеременное окисление и восстановление, казалось бы, не влияют на этот катализатор, они делают чрезвычайно активными медные и никелевые катализаторы. Боу-ден и Райдил [89] нашли, например, что окисление и восстановление их никелевой пластинки трижды увеличили истинную поверхность в 46 раз по сравнению с кажущейся. Действие промотора А1203 в железном катализаторе является другим примером активации путем увеличения поверхности. [37]
Активация всегда сопровождается увеличением поверхности адсорбента. Наиболее общим методом активации металлических катализаторов являются попеременное окисление и восстановление. Мы видели, что восстановление увеличивает поверхность катализатора Fe304 примерно в 100 раз. В то время как попеременное окисление и восстановление, казалось бы, не влияют на этот катализатор, они делают чрезвычайно активными медные и никелевые катализаторы. Боу-ден и Райдил [89] нашли, например, что окисление и восстановление их никелевой пластинки трижды увеличили истинную поверхность в 45 раз по сравнению с кажущейся. Действие промотора А1203 в железном катализаторе является другим примером активации путем увеличения поверхности. [38]
Для обсуждения влияния ингибиторов необходимо знать механизм каталитического действия Fe3 на окисление о-аминофенола. Каталитическое действие Fe3 может быть связано с механизмом попеременного окисления и восстановления Fe3 или с окислительно-восстановительным процессом в разнолигандном комплексе, где к Fe3 координированы частицы Н2Ог и о-аминофенола. [39]
Кроме того, повышение концентрации ионов железа в растворе сопровождается увеличением содержания железа в осадок с диоксида, образующегося на графитовом аноде. Причина влияния ионов железа состоит не только в их попеременном окислении и восстановлении на электродах. Как полагают некоторые авторы, в присутствии ионов железа возрастает поляризация анода при выделении диоксида марганца и увеличивается доля тока, расходуемая на побочную электрохимическую реакцию выделения кислорода. [40]
В качестве электролита в нем применялся 27 % - ный водный раствор КОН. Полые цилиндрические электроды были изготовлены из никелевой сетки и активированы путем попеременного окисления на воздухе и восстановления в атмосфере водорода. [41]
Фотокаталитическая реакция на ZnO не будет осуществляться, если один из конечных или промежуточных продуктов превращения восстановителя обладает повышенной, по сравнению с окислителем, реакционной способностью по отношению к электронам. Это правило основано на процессе рекомбинации электрона с дыркой при попеременном окислении и восстановлении химических частиц. Если N более реакционноспособен в отношении электронов, чем окислитель, то будет осуществляться циклический процесс, согласно уравнениям ( XVIII) и ( XIX), и не произойдет никакого химического изменения. [42]
Фотокаталитическая реакция на ZnO не будет осуществляться, если один из конечных или промежуточных продуктов превращения восстановителя обладает повышенной, по сравнению с окислителем, реакционной способностью по отношению к электронам. Это правило основано на процессе рекомбинации электрона с дыркой при попеременном окислении и восстановлении химических частиц. Если N более реакционноспособен в отношении электронов, чем окислитель, то будет осуществляться циклический процесс, согласно уравнениям ( XVIII) и ( XIX), и не произойдет никакого химического изменения. [43]
Авторы работы [64] считают, что СО при образовании карбоксилатных структур реагирует с кислородом решетки. В таком случае предлагаемый ими механизм является стадийным, так как окисление СО сопровождается попеременным окислением - восстановлением поверхности. СО за счет кислорода решетки не идет. [44]
Был сделан вывод, что колебания скорости реакции окисления водорода на металлическом катализаторе связаны с попеременным окислением и восстановлением поверхности катализатора, как это ранее предполагал Куртанек [119, 120] ( см. разд. О работе Раджагопалана 165 ] по изучению окисления Н2 см. разд. [45]
Страницы: 1 2 3 4