Поверхностное окисление
Cтраница 1
Поверхностное окисление Pt304 может быть обнаружено следующим образом. Сравнение хода поляризационных кривых показывает, что в стационарных условиях скорость анодного процесса резко уменьшается. Такое уменьшение силы анодного тока возможно только при образовании на электроде новой твердой фазы. По мере накопления на электроде твердого продукта реакции скорость его образования уменьшается, вследствие чего сила тока падает. [1]
Поверхностное окисление бора медленно протекает уже при контакте бора с воздухом и особенно в присутствии влаги. Скорость поверхностного окисления заметно возрастает с увеличением степени дисперсности частиц бора. [2]
Поверхностное окисление титана в водных растворах протекает легче, чем его растворение. Стационарные потенциалы титана в нейтральных и слабокислых электролитах находятся в положительной области. [3]
Поверхностное окисление металла упрочнителя осуществляют при распылении жидкого металла в контролируемой окислительной атмосфере. Внутреннее окисление заключается в контролируемом окислении порошков низколегированных твердых растворов. Окисляется компонент, имеющий большее сродство к кислороду, при температуре, обеспечивающей необходимую скорость диффузии кислорода. [4]
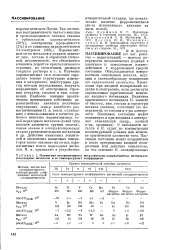 |
Магнитная восприимчивость металлических парамагнитных материалов ( переходных металлов и ее температурный коэффициент. [5] |
Обусловливается поверхностным окислением металла, ведущим к скачкообразному повышению его коррозионной стойкости. Происходит при анодной поляризации изделия в электролите, если достигнута определенная ( критическая) величина анодного потенциала. Пассивное состояние может возникнуть и при введении в электролит окислителей ( напр. [6]
При поверхностном окислении кислород присоединяется к углю в виде ряда промежуточных соединений, угле-кислородных комплексов, перекисей. Конечной стадией его является образование активных кислородсодержащих групп. Происходит окисление в боковых и соединительных цепях макромолекул углей, наряду с кислородсодержащими группами образуются гидролизуемые связи на периферии и между структурными звеньями макромолекул. [7]
Первая - поверхностное окисление, когда наблюдается присоединение кислорода с образованием на поверхности угля групп, обладающих кислотными свойствами. Скорость, с которой протекает этот процесс, определяется степенью углефикации, температурой, парциальным давлением кислорода и суммарной поверхностью частиц. На этой стадии не образуется продуктов, растворимых в щелочи. [8]
С идет поверхностное окисление. II) СиС12, легко взаимодействует с другими галогенами. [9]
После некоторого поверхностного окисления довольно хорошо противостоят действию озона Си, Ni и Sn. He разрушается озоном также сплав железа ( не содержащего углерода) с 25 % хрома. [10]
После некоторого поверхностного окисления довольно хорошо противостоят действию озона Си, Ni и Sn. He разрушается озоном также сплав железа ( не содержащего углерода); с 25 % хрома. [11]
После некоторого поверхностного окисления довольно хорошо противостоят действию озона Си, Ni и Sn. He разрушается озоном также сплав железа ( не содержащего углерода) с 26 % хрома. [12]
В процессе поверхностного окисления металлов, сопровождаемом диффузией ионов металла сквозь образовавшийся окисел, заряды, переносимые ионами, компенсируются потоком электронов сквозь ту же окись. [13]
Образующаяс от поверхностного окисления углерода углекислота не является устойчивым образованием вблизи разогретой углеродной поверхности. [14]
Страницы: 1 2 3 4
