Каталитическое окисление - окись - углерод
Cтраница 3
Аналогию можно провести далее, если более тщательно исследовать активность закиси никеля как окислительного катализатора. При обменной реакции HZ-DZ на ZnO наблюдается период активации, соответствующий восстановлению поверхности; в случае же каталитического окисления окиси углерода на NiO имеет место период дезактивации, также соответствующий восстановлению поверхности. [31]
Фильтрующие противогазы, обычно употребляемые для защиты от отравляющих газов, от окиси углерода не предохраняют, так как активированный уголь не поглощает СО. Для предохранения от окиси углерода нужно применять специальные противогазы, в которых коробка содержит гопкалит: смесь различных окислов, главным образом двуокиси марганца, окиси меди и др. Его действие состоит в каталитическом окислении окиси углерода до углекислого газа. Поскольку при этом происходит выделение тепла, проходящий через такой противогаз воздух нагревается, что создает неудобство, так как дышать приходится нагретым воздухом. [32]
Так, авторы работы [58] наблюдали в присутствии кислорода фасетирование граней ( 100) и ( НО) вольфрама, хотя в вакууме эти грани устойчивы. Так, Гуотми [14] приводит данные о фасети-ровании граней ( 100) и ( НО) меди в процессе каталитической реакции водорода и кислорода при 670 К - Баддур и др. [59] нашли, что в результате каталитического окисления окиси углерода на палладии при 450 К характер ИК-спектров адсорбированной СО определенным образом изменяется в соответствии с изменениями кинетических параметров реакции, и истолковали этот факт как следствие перестройки поверхности палладия. [33]
Различают гомогенный и гетерогенный катализ. При гомогенном катализе катализатор и реагирующие вещества образуют однородную систему. Примером может служить каталитическое окисление окиси углерода до углекислого газа в присутствии паров воды или гидролиз водных растворов углеводов в присутствии кислоты. В обоих этих случаях границы раздела между катализатором и реагирующими веществами отсутствуют. [34]
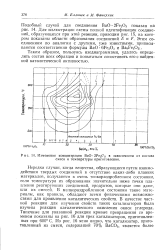 |
Изменение концентрации ВаО 2Fe2O3 в зависимости от состава смеси и температуры приготовления. [35] |
Нередки случаи, когда вещества, образующиеся путем взаимодействия твердых соединений в отсутствие каких-либо плавких материалов, получаются в очень тонкораздробленном состоянии, если температура их образования значительно ниже точки плавления реагирующих соединений, продуктов, которые они дают, или их смесей. В мелкораздробленном состоянии такие материалы, как правило, обладают всеми физическими возможностями для проявления каталитических свойств. В качестве частной реакции для изучения свойств таких катализаторов была изучена реакция каталитического окисления окиси углерода. Типичные для указанной реакции кривые превращения со временем показаны на рис. 16 для трех катализаторов, приготовленных при 600 С. [36]
Для каждого из этих окислов было показано, что окись углерода способна реагировать не только с кислородом решетки, но и с адсорбированным кислородом. Концепция необратимой хемосорбции с образованием карбонатного иона, сопровождающимся восстановлением, остается приемлемым объяснением фактов в случае взаимодействия СО с этими окислами при температурах выше 100 - 200, но при комнатной температуре можно различить другие процессы. В настоящем разделе дано описание чисто химических аспектов этой работы и показано значение полученных данных в выяснении вопроса каталитического окисления окиси углерода при низких температурах. В целом это исследование является примером классического подхода в гетерогенном катализе к фундаментальной проблеме связи каталитической активности со стабильностью адсорбированных частиц. [37]
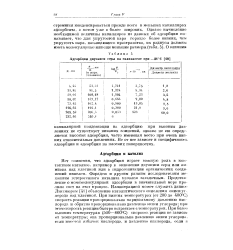 |
Адсорбция двуокиси серы на силикагеле при - 34 С. [38] |
Нет сомнения, что адсорбция играет важную роль в контактном катализе, например в окислении двуокиси серы или аммиака над платиной или в гидрогенизации органических соединений никелем. Иллюстрацией может служить данное Лзнгмюром [41] объяснение каталитического окисления окиси углерода над платиной. При низких температурах ( от 200 до 400 С) скорость реакции пропорциональна парциальному давлению кислорода и обратно пропорциональна давлению окиси углерода; при атом скорость реакции быстро возрастает с температурой. [39]
Эта же реакция разложения на окислах n - типа ( например, на ZnO) сопровождается уменьшением электропроводности катализатора. Кроме того, Бейкер и Дженкинс указали, что результаты опытов по введению в окислы добавок ( см. разд. Теперь обратимся к сопоставлению каталитической активности полупроводниковых окислов в процессе окисления окиси углерода. Шваб [ 97 показал, что характер дефектов ( электронные свойства) окислов металлов, играет доминирующую роль в каталитическом действии этих твердых тел. Как было объяснено ранее в этой главе, Вервей [26, 27] показал, что добавление одновалентных катионов, таких, как литий, к матрице из окисла никеля дает в результате увеличение числа дырок в этом окисле и, следовательно, повышает проводимость jj - типа. И, наоборот, при добавлении трехвалентных ионов ( таких, как хром) число дырок уменьшается и проводимость, следовательно, снижается. В нижней части рис. 23: Шваб приводит данные Вервея [26] и Хауффе [98], иллюстрирующие влияние добавленных ионов на проводимость закиси никеля. В верхней части рисунка приведены данные, полученные для реакции каталитического окисления окиси углерода. [40]
В большинстве случаев можно предположить несколько схем протекания каталитического процесса, которые приводят к одному и тому же кинетическому уравнению. Мне кажется, что в первый период применения этого метода им слишком увлекались. Если посмотреть первые работы в этой области, то создается впечатление, что авторы их считали возможным во всех случаях совершенно однозначно толковать результаты, полученные при применении тяжелого кислорода. Если кислород катализатора переходит в продукты реакции, то реакция протекает за счет попеременного окисления и восстановления катализатора. Если этого перехода нет, значит кислород, связанный с катализатором, не принимает участия в реакции. Однако противоположные выводы, к которым пришли исследователи при изучении механизма с помощью тяжелого кислорода одной и той же реакции на одном и том же катализаторе, показывают, что данный метод не дает столь однозначных результатов, как это полагали вначале. В частности, так обстоит дело, например, с использованием тяжелого кислорода для выявления механизма каталитического окисления окиси углерода на двуокиси марганца. [41]
Страницы: 1 2 3