Электрохимическое окисление - металл
Cтраница 1
Селективное электрохимическое окисление металлов ( А1, Та) широко применяется при формировании тонкопленочных конденсаторов и диэлектрических слоев при создании многослойных структур. Фоторезист в данном случае используется в качестве защитной маски при анодировании. [1]
Явление и процесс электрохимического окисления металла, приводящие к образованию растворимых продуктов. [2]
 |
Анодная потенциостатическая кривая для металла, склонного переходить в пассивное состояние ( обозначения в тексте. [3] |
Однако одновременно интенсифицируется и реакция электрохимического окисления металла кислородом. При этом увеличивается и толщина пленки, что затрудняет выход катионов металла из решетки в электролит. В результате этих двух противоположно действующих факторов анодный ток слабо меняется с изменением потенциала или остается постоянным. [4]
Описание роста анодной оксидной пленки ( АОП), являющейся непосредственным продуктом электрохимического окисления металла, требует учета миграционного и диффузионного переноса через пленку реагентов ( межузельных ионов, дефектов, молекул воды), а также кинетики процессов, протекающих на внешней и внутренней границах пленки. [5]
Рост оксидной пленки зависит от двух взаимно-противоположных процессов: образования ее в результате электрохимического окисления металла и химического растворения пленки в электролите. [6]
Отмечая значительную общность в составе и свойствах пассивирующих пленок, полученных в результате химического и электрохимического окисления металла, нужно подчеркнуть, что на ранних стадиях адсорбции кислорода этого сходства не наблюдается. [7]
Формирование оксида происходит в условиях одновременного воздействия на процесс двух противоположно направленных реакций - электрохимического окисления металла в глубине пор и химического растворения оксидного слоя на его внешней поверхности, подвергающейся активному воздействию электролита. [8]
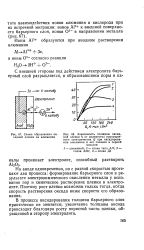 |
Схема образования оксидной пленки на алюминии.| Зависимость толщины оксидной пленки h от количества пропущенного электричества Q при оксидировании алюминия и его сплавов в серной. [9] |
На аноде одновременно, но с разной скоростью протекают два процесса: формирование барьерного слоя в результате электрохимического окисления металла у основания пор и химическое растворение пленки в электролите. Поэтому рост пленки возможен только тогда, когда скорость растворения оксида ниже скорости его образования. [10]
Ценность покрытия определяется его влагонепроницаемо-стью, так как наличие влаги является необходимым, хотя и недостаточным условием для электрохимического окисления металлов. [11]
Ценность покрытия определяется его влагонепроницаемостью, так как наличие влаги является необходимым, хотя и недостаточным условием для электрохимического окисления металлов. [12]
 |
Сравнительные данные об изменении ингибиторами 9, / и i при потенциале частичной пассивации. [13] |
На основании изложенного механизм действия ингибиторов неокислительного типа можно представить следующим образом: затормозив анодную реакцию ионизации металла благодаря образованию труднорастворимых соединений или непосредственного электрохимического окисления металла, эти ингибиторы смещают потенциал металла к таким значениям, при которых становится возможным окисление металла кислородом воды. [14]
Повышенные выходы по току при анодном растворении металлов могут иметь место и вследствие стадийного протекания процесса, когда одной из стадий, следующих за электрохимическим окислением металла до иона промежуточной валентности, является стадия окисления такого иона компонентами раствора. В этом случае для снижения скорости растворения часто пригодны обычные электрохимические способы, основанные на смещении потенциала в направлении, предсказываемом теорией. [15]
Страницы: 1 2