Полное окисление
Cтраница 2
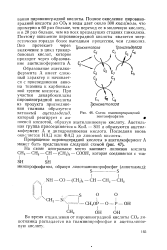 |
Схема взаимопревращений пентозофосфатов. [16] |
Полное окисление пировино-градной кислоты до СО2 и воды дает около 300 ккал / моль, что примерно в 60 раз больше, чем переход ее в молочную кислоту, и в 20 раз больше, чем на всех предыдущих стадиях гликолиза. Поэтому окисление пировиноградной кислоты является энергетически гораздо более выгодным процессом, чем гликолиз. Оно протекает через включение в цикл трикар-боновых кислот, которое проходит через образование ацетилкофермента А. [17]
Полное окисление ароматических углеводородов при помощи воздуха требует определенной температуры. [18]
Полное окисление части сероводорода приводит к образованию высокотемпературных газов. [19]
Полное окисление сульфида ниобия в токе кислорода ( табл. 54) до Nb2O5 происходит при 400 - 500 С. [20]
Полное окисление двухвалентного олова хлорной ртутью протекает в течение 3 - 5 мин. За указанное время в растворе должна образоваться белая муть или осадок. При отсутствии указанных признаков избытка хлористого олова не может быть уверенности в полном восстановлении всего железа до двухвалентного. [21]
Полное окисление сернистого газа и окислов азота заканчивается через 30 - 40 мин. В течение этого времени колбу периодически встряхивают. По окончании окисления измеряют разрежение в колбе. Содержимое колбы переносят в мерную колбу емкостью 250 мл, обмывая стенки колбы небольшими порциями дистиллированной воды, нейтральной по метиловому красному; промывные воды сливают в ту же мерную колбу. Объем доводят до метки дистиллированной водой и раствор тщательно перемешивают. [22]
Практически полного окисления почти всех растворимых в воде, а также многих нерастворимых органических примесей, достигают отработкой пробы раствором бихромата калия в сильно сернокислой среде в присутствии сульфата серебра в качестве катализатора и сульфата ртути ( II) в качестве маскирующего хлориды вещества. [23]
Такое полное окисление глюкозы пофосфоглюконатному пути не может быть представлено во всех клетках. По-видимому, фосфоглюконатный путь чаще всего на одном из участков пересечения переходит в гликолитический. [24]
Для полного окисления всех серосодержащих соединений потребовалось бы применение повышенной температуры или многосуточная аэрация, что не экономично. [25]
Для полного окисления реакционную массу после введения бертолетовой соли выдерживают при 80 - 90 С и перемешивании в течение 30 - 40 мин. Конец реакции окисления определяют по отсутствию ионов Fe2 в маточном растворе. Для этого через бумажный фильтр отфильтровывают взятую из колбы пробу и добавляют к фильтрату 10 % - ный раствор ферроцианида калия. Больший избыток окислителя приводит к получению пигмента зеленого цвета. [26]
Для полного окисления характерна высокая нитрификация ( количество нитратов достигает 24 мг / л) и минерализация ( зольность составляет до 34 2 %) активного ила. [27]
Установки полного окисления могут эксплуатироваться без удаления и с удалением избыточного активного ила. [28]
Дня полного окисления ее служат окислительные камеры, которые представляют каменные кислотоупорные башни. [29]
Время полного окисления зависит от начальной коцентрации сероводорода. [30]
Страницы: 1 2 3 4