Катализированное окисление - углеводород
Cтраница 1
Катализированное окисление углеводородов часто протекает в 2 стадии: в первой стадии катализатор находится в растворе и, инициируя цепи, ускоряет окисление, во второй - он выпадает в осадок и не принимает участия в инициировании цепей. Однако такое резкое разделение, реакций на две стадии встречается не всегда. [1]
Механизм катализированного окисления углеводородов отличается от окисления в отсутствие металлов переменной валентности. Введение катализаторов прежде всего сказывается на механизме образования радикалов. При окислении в отсутствие катализатора основным источником радикалов является термический распад гидроперекиси, в присутствии катализатора - ее взаимодействие с катализатором. [2]
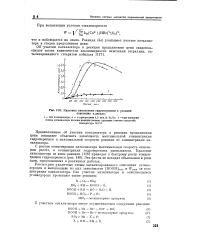 |
Кинетика накопления гидроперекиси в реакции окисления н. декана. [3] |
Рассмотрим различные схемы катализированного окисления углеводородов и вытекающие из них зависимости [ ROOH ] max и Wmax от концентрации катализатора. [4]
Наличие макроскопических стадий в катализированном окислении углеводородов обусловлено, по-видимому, изменением физико-химических свойств катализатора в углеводородном растворе по мере накопления молекулярных продуктов окисления. В уксуснокислых растворах, где катализатор в течение исего процесса полностью диссоциирован на ионы, макроскопической стадийности не наблюдается. В углеводородном растворе катализатор весьма чувствителен к полярным веществам. Его растворимость в значительной степени зависит от полярности среды, аниона, входящего в состав соли. Образование комплексов с продуктами окисления может влиять на активность катализатора. [5]
Наличие макроскопических стадий в катализированном окислении углеводородов обусловлено, по-видимому, изменением физико-химических свойств катализатора в углеводородном растворе по мере накопления молекулярных продуктов окисления. В уксуснокислых растворах, где катализатор в течение всего процесса полностью диссоциирован на ионы, макроскопической стадийности не наблюдается. В углеводородном растворе катализатор весьма чувствителен к полярным веществам. Его растворимость в значительной степени зависит от полярности среды, аниона, входящего в состав соли. Образование комплексов с продуктами окисления может влиять на активность катализатора. Из продуктов окисления, оказывающих влияние на агрегатное состояние катализатора, важная роль принадлежит кислотам. На опыте неоднократно наблюдалось, что в реакциях окисления катализатор выпадает в осадок в виде солей кислот, образующихся при окислении. Однако выпадение катализатора в осадок в ходе реакции окисления - результат не простой обменной реакции между солью и кислотой, а сложный процесс, в котором наряду с кислотами принимают участие и другие продукты окисления, в частности вода. Макроскопические стадии в процессе катализированного окисления ( изменение валентного состояния катиона, выпадение катализатора в осадок) обычно протекают очень быстро. Добавки некоторых соединений могут значительно удлинять стадии валентных превращений. Так, марганцовый катализатор в реакции окисления синтина в начале тормозит окисление ( Мп2 обрывает цепи), затем, превратившись в Мп34, ускоряет процесс окисления, но довольно скоро выпадает в осадок. При окислении синтина в присутствии смесей нафтенатов марганца и калия стадии валентных превращений марганца удлиняются: период торможения увеличивается с 10 до 40 мин. [6]
Несмотря на большую сложность механизма катализированного окисления углеводородов, сейчас уже известны основные закономерности этих процессов, зная которые, можно ставить и решать разнообразные задачи управления процессом окисления. Эти данные позволяют осуществить на практике более тонкие приемы регулирования окисления, основываясь на знании элементарных процессов катализированного окисления углеводородов и другв: х органических веществ. [7]
Несмотря на большую сложность механизма катализированного окисления углеводородов, сейчас уже известны основные закономерности этих процессов, зная которые, можно ставить и решать разнообразные задачи управления процессом окисления. Эти данные позволяют осуществить на практике более тонкие приемы регулирования окисления, основываясь на знании элементарных процессов катализированного окисления углеводородов и других органических веществ. [8]
Объединение молекул соли в мицеллы необходимо учитывать при рассмотрении механизма катализированного окисления углеводородов. От степени ассоциации молекул катализатора зависит его активность. [9]
Объединение молекул соли в мицеллы необходимо учитывать при рассмотрении механизма катализированного окисления углеводородов. От степени ассоциации молекул катализатора зависит его активность. [10]
При Ад Ю-2-Ю-3 сек-1 ( такие значения ka наблюдаются в реакциях катализированного окисления углеводородов) период индукции резко возрастает вблизи критической концентрации ингибитора, в то время как при & з 10 - 5 сек-1 переход от одного режима к другому происходит плавно. [11]
При ka Ю-2-Ю-3 сек-1 ( такие значения ka наблюдаются в реакциях катализированного окисления углеводородов) период индукции резко возрастает вблизи критической концентрации ингибитора, в то время как при ka Ю-5 сек-1 переход от одного режима к другому происходит плавно. [12]
 |
Зависимость периода индукции ги в реакции окисления н. декана от концентрации введенного стеарата меди. [13] |
Сведения о растворах органических солей металлов переменной валентности в углеводородах позволяют правильно понять некоторые кинетические особенности катализированного окисления углеводородов и те изменения, которые претерпевает катализатор в ходе реакции из-за накопления разнообразных продуктов окисления. [14]
 |
Кинетические кривые расходования Fes в реакции окисления циклогексана. [15] |
Страницы: 1 2