Достаточно сильный окислитель
Cтраница 1
 |
Схема выделения фтора из плавикового шпата. [1] |
Достаточно сильные окислители окисляют бромиды и иодиды до галогенов. [2]
При использовании достаточно сильных окислителей ( шере-киси водорода, азотной кислоты, гипохлорита, двуокиси хлора) трудно регулировать степень окисления лигнина, так как реакция не останавливается до тех пор, пока он не будет разложен до водорастворимых продуктов, при условии, что эта ( реакция искусственно не прерывается через определенное время. [3]
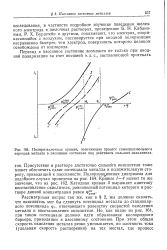 |
Поляризационные кривые, поясняющие процесс самопроизвольного перехода металла в пассивное состояние под действием сильного окислителя. [4] |
Присутствие в растворе достаточно сильного окислителя тоже может обеспечить сдвиг потенциала металла в положительную сторону, приводящий к пассивности. [5]
Бром и иод - достаточно сильные окислители, хотя и уступают по активности фтору и хлору. В ряду F-At снижается окислительная активность простых веществ. [6]
Бром и иод - достаточно сильные окислители, хотя и уступают по активности фтору и хлору. В ряду F - At снижается окислительная активность простых веществ. [7]
Бром и иод - достаточно сильные окислители, хотя и уступают по активности фтору и хлору. Поскольку в ряду F - С1 - Вг - I - At сродство к электрону уменьшается, в этом ряду снижается окислительная активность простых веществ. [8]
Бром и иод - достаточно сильные окислители, хотя и уступают по активности фтору и хлору. В ряду F - At снижается окислительная активность простых веществ. [9]
При наличии в растворе достаточно сильных окислителей состояние равновесия невозможно, так как окислитель, восстанавливаясь, расходует отрицательные заряды, имеющиеся на металле. Равновесие зарядов в двойном слое нарушается, и металл, по мере восстановления окислителя, непрерывно посылает свои катионы в раствор. [10]
Если в расплаве нет достаточно сильных окислителей, то после возникновения двойного электрического слоя процесс растворения может прекратиться по достижении состояния равновесия. При этом металл заряжается отрицательно, а расплав положительно. На границе раздела происходит непрерывный обмен ионами, поскольку эта реакция обратима. [11]
В случае отсутствия в растворе достаточно сильных окислителей по отношению к рассматриваемому металлу переход ион-атомов из кристаллической решетки в раствор не может продолжаться длительное время; этому процессу препятствуют силы взаимодействия между электрически заряженными частицами в двойном слое - положительными в растворе и отрицательными на металле. Дальнейший переход ион-атомов в раствор прекращается и при определенном значении скачка потенциала наступает состояние равновесия. Величина этого скачка для разных металлов различна, меняется в зависимости от природы раствора и его концентрации и характеризует окислительно-восстановительную способность металла. [12]
Ароматические кольца раскрываются под действием достаточно сильных окислителей. [13]
Как видно, Се4 является достаточно сильным окислителем. Потенциал пары Се4 / Се3 1 существенно зависит от кислотности раствора и природы кислоты. В выше, чем в серной или соляной. Зависимость от концентрации кислоты связана с ярко выраженной гидролизуемостью иона Се4, вследствие чего растворы Се4 готовят в присутствии кислоты и цериметриче-ские титрования проводят в кислой среде. Зависимость потенциала пары Се4 / Се3 от природы кислоты вызывается, по-видимому, образованием соответствующих комплексов, связывающих Се4 и понижающих, таким образом, потенциал пары. [14]
Как видно, Се4 является достаточно сильным окислителем. Потенциал пары Се4 / Се3 существенно зависит от кислотности раствора и природы кислоты. В выше, чем в серной или соляной. Зависимость от концентрации кислоты связана с ярко выраженной гидролизуемостью иона Се4, вследствие чего растворы Се4 готовят в присутствии кислоты и цериметриче-ские титрования проводят в кислой среде. Зависимость потенциала пары Се4 / Сеэ от природы кислоты вызывается, по-видимому, образованием соответствующих комплексов, связывающих Се4 и понижающих, таким образом, потенциал пары. [15]
Страницы: 1 2 3 4