Достаточно сильный окислитель
Cтраница 3
Кадмий в щелочах практически не растворяется, а в кислотах - менее энергично, чем цинк; ртуть же растворяется только в кислотах, являющихся достаточно сильными окислителями за счет своих анионов. [31]
 |
Изменение давления в упаковке по мере расходования препарата ( растворитель - Aerothene MM. [32] |
В растворах закись азота имеет склонность к реакциям восстановления и окисления. В присутствии достаточно сильных окислителей она может разлагаться до азота и кислорода, а также окисляться до дву окиси азота. Поэтому в благоприятных условиях закись азота может участвовать в процессах коррозии металла, а также реагировать с компонентами содержимого аэрозольной упаковки. [33]
Титрант, используемый при окислительно-восстановительном титровании, должен удовлетворять общим требованиям титриметрических методов анализа ( см. гл. Он должен быть достаточно сильным окислителем илц восстановителем, чтобы реагировать практически до конца с титруемым веществом. Это требование означает, что реальный потенциал системы титранта должен быть значительно более положительным для окислителей и соответственно более отрицательным для восстановителей, чем реальные потенциалы систем титруемых компонентов. Но титрант не должен быть настолько сильным, чтобы реагировать с некоторыми другими компонентами раствора, помимо определяемого. [34]
Использование прибора с двухполярным выходом имеет особое значение в том случае, когда потенциал металла химического аппарата при отсутствии защиты может меняться в относительно широких пределах за счет изменения условий эксплуатации. Например, наличие в электролите достаточно сильного окислителя может смещать потенциал в область нарушения пассивности и для поддержания его в пассивной области будет необходима катодная поляризация. При изменении концентрации окислителя в ходе технологического процесса катодный ток при заданном потенциале может уменьшаться и изменить свое направление на анодное. Это означает, что при поддержании постоянного потенциала в пассивной области аппарат будет находиться попеременно в условиях катодной и анодной поляризации. Понятно, что такую защиту нельзя называть катодной или анодной; такую защиту целесообразно называть потенциостатической. [35]
Связывание ионов Аи3 1 в комплексный ион [ АиС14 ] - смещает равновесие ( 1) слева направо. В этих условиях HNO3 оказывается достаточно сильным окислителем для золота. [36]
Связывание ионов Аи3 в комплексный ион [ АиС14 ] - смещает равновесие в уравнении 1 слева направо. В этих условиях HNO3 оказывается достаточно сильным окислителем для золота. [37]
Метод, основанный на окислении гипоиодитом имеет ограниченное применение. Основной недостаток этого метода связан с тем, что гипоиодит достаточно сильный окислитель и окисляет многие некарбонильные соединения. [38]
Поэтому, как и золото, серебро не вытесняет водород из водных растворов кислот, устойчиво по отношению к щелочам. Однако в отличие от золота оно растворяется в кислотах, являющихся достаточно сильными окислителями, например, в азотной и концентрированной серной. Подобно золоту, серебро легко взаимодействует с царской водкой и насыщенной хлором соляной кислотой, но при этом оно остается в нерастворимом остатке вследствие образования малорастворимого хлорида AgCl. Такие различия в поведении золота и серебра часто используют для разделения этих металлов. [39]
Вывод о том, что коррозия возможна только. Чистая ртуть, имеющая вполне однородную ( жидкую) поверхность, окисляется в достаточно сильных окислителях ( HNOs, конц. Окисляются ионами Н и многие металлы, растворенные в ртути, например, тот же цинк. Число исследований электрохимического поведения металлов менее благородных, чем ртуть, в жидких амальгамах весьма велико. Вполне однородная поверхность жидкой амальгамы не препятствует окислению металлов, растворенных в ртути. Наконец, если для таких металлов как цинк легко найти более благородные примеси, играющие роль катодов, то какие могут быть более благородные примеси для золота или платины, которые электрохимически растворяются в достаточно сильных окислителях. Таким образом, одно из логических следствий теории местных элементов, хотя не все авторы это следствие отчетливо формулируют, не выдерживает экспериментальной проверки. [40]
Дихалькогениды ЭХ 2 известны только для Ge и Sn, с одной стороны, и для S, Se - с другой. С формальной точки зрения этот факт можно объяснить тем, что теллур не является достаточно сильным окислителем, чтобы стабилизировать высшую степень окисления для Ge и Sn. Для свинца высшая степень окисления вообще малохарактерна и в этом отношении и сера, и селен, и теллур недостаточно активны для образования дихалькогенидов. [41]
Рассмотрев условия, приводящие металл в пассивное состояние, мы можем легко понять причины, вызывающие снятие кислородного барьера и депассивацию электрода. Если электрод, самопроизвольно запассивированный в некотором растворе, перенести в другой раствор, в котором нет достаточно сильного окислителя, то отпадет причина, поддерживающая высокий положительный потенциал, вследствие чего начнется снятие кислородного барьера и депассивация электрода. [42]
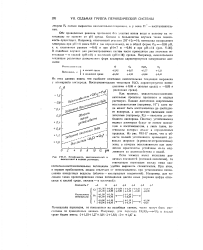 |
Устойчивость восстановителей и окислителей в водных растворах. [43] |
Как правило, окислительно-восстановительные процессы протекают в водных растворах. Однако достаточно энергичными восстановителями ( например, Н) сама вода может быть восстановлена до свободного водорода, а достаточно сильными окислителями ( например, р2 - окислена до свободного кислорода. Поэтому устойчивыми в водных растворах будут не всякие окислители и восстановители, а лишь такие, потенциалы которых лежат в определенных пределах. Из рис. VII-17 видно, что к области полной устойчивости примыкают довольно широкие ( и резко не отграниченные) зоны, в которых восстановители или окислители практически устойчивы из-за медленности их взаимодействия с водой. [44]
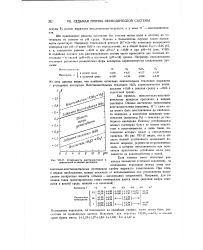 |
УСТОЙЧИВОСТЬ восстановителей и окислителей в водных растворах. [45] |
Страницы: 1 2 3 4