Окись - железо
Cтраница 1
Окись железа; механически спрессованные окись железа и окись хрома ( 10 мол. [1]
Окись железа, содержащая титан, в том виде, как она получается в производстве боксита; контактная масса, состоящая из монацитового песка, кобальта, никеля, МР. [2]
Окись железа в этом случае рассматривается как активный агент, MgO - связующее и носитель, а К2О катализирует реакцию водяного пара с начинающим откладываться коксом. [3]
Окись железа ( III), полученная при осаждении водным раствором аммиака, формиатом аммония или с применением куп-ферона, достигает своей постоянной массы при использовании регистрирующих термовесов21 соответственно при 470, 296 и 610 С. Бакстер и Гувер26 показали, что чистая Fe2O3 при нагревании до 1100 С теряет только 0 004 % своей массы. [4]
Окись железа ( Fe2O3) получалась разложением гидроокиси при 500 в токе кислорода к течение 8 часов. [5]
Окись железа, образующаяся при обжиге колчедана в печах различной конструкции, выходит из печи в виде огарка и поступает в отвал. [6]
Окись железа Fe2O3, называемая в производстве железным огарком, опускается в низ печи и оттуда в отход. Выходящая из печи горячая смесь двуокиси серы с воздухом, загрязненная различными примесями, поступает в электрофильтр для очистки от пыли. Из электрофильтра газовая смесь направляется в промывную башню, орошаемую сверху разбавленной серной кислотой. Внутренность промывной башни заполнена сделанными из глины полыми цилиндриками-кольцами, поставленными друг на друга. Таким устройством увеличивается внутренняя поверхность башни, вследствие чего достигается более длительное соприкосновение поступающей снизу газовой смеси и медленно стекающей сверху серной кислоты. Серная кислота взаимодействует с примесями, находящимися в газовой смеси, удаляя тем самым их из смеси. [7]
Окись железа катализирует разложение перекиси водорода на воду и кислород. [8]
Окись железа реагирует с серной кислотой слабее чем гидроокись, и может случиться, что она полностьк не растворится даже при нагревании. [9]
Окись железа до конца процесса остается без изменения. Серный ангидрид с новым количеством кислорода действует на сепнистое соединение меди и переводит его в сернокислую соль. По отношению к нагреванию сернокислая медь более прочное соединение, чем сернокислая соль железа; она выдерживает без разложения температуру до 600, тогда как сернокислое железо значительно раньше переходит в окись. [10]
Окись железа ( крокус) - тонкий полировальный порошок, состоящий в основном из кристаллической окиси железа. Получается путем переработки железного купороса и щавелевой кислоты. [11]
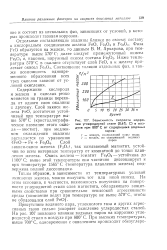 |
Зависимость скорости коррозии углеродистой стали ( 0 6 % С в воздухе при 800 С от содержания водяных паров. [12] |
Окись железа - гематит Fe2O3 - устойчива до 1100 С; выше этой температуры она частично диссоциирует и при температуре 1565 С ( температура плавления железа) подвержена полной диссоциации. [13]
Окись железа отделяют от раствора и возвращают в процесс получения феррита. [14]
Окись железа Fe203, полученная высушиванием гидроокиси железа при НО-120 С, начинает восстанавливаться водородом около 270 С. Реакция при этой температуре протекает довольно медленно, и продукт получается пирофорным. Есть указания 34, что восстановление железа начинается уже при 175 С. [15]
Страницы: 1 2 3 4