Окись - щелочной металл
Cтраница 2
Гидраты окисей щелочных металлов ЗОН представляют собой белые твердые вещества. При нагревании они сравнительно легко плавятся, хорошо растворяются в воде. [16]
При промывке носителя гидратом окиси щелочного металла в водном или метанольном растворе разрушаются каталитические центры без заметного уменьшения эффективности разделения. Иногда одной промывки недостаточно, и твердый носитель - дополнительно пропитывают щелочью. В частности, рекомендован следующий метод обработки носителя [38]: смачивают твердый носитель метанолом и смешивают эту массу в ротационном испарителе с 6 % - ным раствором КОН в метаноле в течение 1 ч ( без нагревания), затем удаляют растворитель вакуумированием и просеивают сухую массу. Наносят, как обычно, жидкие фазы, при этом исключается применение веществ, которые могут реагировать с КОН. [17]
При электролизе раствора гидрата окиси щелочного металла, напр, едкого натра, на аноде разряжаются ОН - исны и образуют кислород и воду по следующему уравн нию: 2 ( ОН) НаО - f - О. [18]
Ломоносова за исследования над окисями щелочных металлов. [19]
Подобно окиси натрия можно получить окиси остальных щелочных металлов. Они имеют желтую окраску, усиливающуюся с возрастанием атомного веса. Окись натрия, так же как окись лития, имеет чисто белый цвет, однако окись калия уже желто-белая, окись рубидия светло-желтая и окись цезия оранжевая. В той же последовательности увеличивается летучесть окисей. [20]
Если исходить из сплавов, содержащих окиси щелочных металлов и двуокись кремния в других количественных соотношениях, Гто получаются смеси обеих кислот или при известных обстоятельствах такие препараты, которые, кроме обеих кислот, будут содержать свободную двуокись кремния. [21]
В Петербурге Н. Н. Бекетов продолжает свои исследования окисей щелочных металлов. Здесь он снова проверяет правильность своих воззрений на то, что реакции совершаются в сторону наибольшего равенства паев. [22]
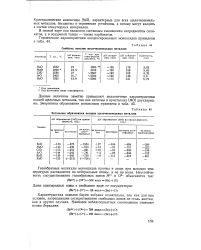 |
Свойства окислов щелочноземельных металлов.| Энтальпии образования оксидов щелочноземельных металлов. [23] |
Данные величины заметно превышают аналогичные характеристики окисей щелочных металлов, так как катионы в кристаллах [ МО ] двухзаряд-ны. [24]
Поскольку всегда имеется достаточное количество гидрата окиси щелочного металла, реакция II ( стр. [25]
При разложении или сгорании этих присадок образуются окиси щелочных металлов, которые понижают вязкость окислов бора и тем самым препятствуют их отложению в камерах сгорания, турбинах и выхлопных соплах реактивных двигателей. Для снижения отложений окиси бора предложено вводить в секции реактивных двигателей, где образуются эти отложения, фтористый водород или трехфтористый бор. Эти соединения в 2 - 3 раза снижают отложения окиси бора. [26]
Приведенные в [54-56] данные показывают, что окиси щелочных металлов в виде индивидуальных соединений не применяются в качестве катализаторов реакций дегидрирования, а используются только как промоторы сложных катализаторов. Гипотезы о механизме действия этих промоторов были рассмотрены выше ( стр. [27]
Можно предположить, что спирт и гидрат окиси щелочного металла сначала образуют алкоголят; при взаимодействии с этим алкоголятом молекула ацетилена вклинивается между кислородом и щелочным металлом. Последняя взаимодейстнует с дополнительными количествами спирта, образуя виниловый эфир и алкоголят, после чего вповь выделившийся алкоголят снова вступает в соединение с ацетиленом. [28]
Проведено исследование фазового состава каталитически активных систем железа - окиси щелочного металла методом ЯГР-спектроскопии. Показано, что различия мессбауэровских параметров ортоферритов, полиферритов, других составляющих фаз позволяют уверенно идентифицировать эти фазы в исследуемых системах. [29]
Явление испускания ионов состоит несомненно из следующих элементарных процессов: восстановление окиси щелочного металла, диффузия щелочного атома к поверхности и испарение его в виде положительного иона. Так как сродство внешних электронов щелочного атома к металлу поверхности больше, чем к самому щелочному атому, то при испарении щелочной атом оставляет один электрон на поверхности, покидая ее таким образом в виде положительного иона. [30]
Страницы: 1 2 3 4