Окись - празеодим
Cтраница 1
Окись празеодима ( Рг2Оз) каталитически влияет на низкотемпературное окисление аммиака. [1]
Окись празеодима, полученная из окса-лата, имеет формулу РгвОЦ) когда прокаливание проводят на воздухе, и РгаОв в случае прокаливания в токе водорода при 900 - 1000 С. Церий после прокаливания при 1200s С всегда взвешивают в виде двуокиси QeOa, которая не легко восстанавливается до Се203 при прокаливании в атмосфере водорода. [2]
Окись празеодима ( Рг Оз) каталитически влияет на низкотемпературное окисление аммиака. [3]
Изучение фаз в системе окись празеодима - окись тербия. [4]
Головной эталон, содержащий по 1 % окиси празеодима и окиси неодима, готовят следующим образом. [5]
Окись самария сульфидируют по спо-еобу, описанному для окиси празеодима. Загрузка окиси самария составляет 50 г; оптимальными условиями являются: температура 1300, время сульфидирования 4 часа. [6]
Чувствительность метода в растворе составляет: 0 008 о для окиси празеодима; 0 008 % для окиси неодима и 0 03 % для окиси самария. [7]
Окись неодима служит для окраски стекол в красно-фиолетовый цвет, а окись празеодима - в зеленый цвет. [8]
При прокаливании 1 293 г сульфата празеодима Pr2 ( SO4) 3 - 8H2O получают 0 598 г окиси празеодима. Предполагая, что окись имеет формулу Рг2О3, напишите уравнение реакции прокаливания и вычислите атомный вес празеодима. [9]
Сероводород, полученный действием соляной кислоты на сульфид железа, очищают от паров хлористого водорода и влаги последовательным пропусканием его через дистиллированную воду, безводный хлористый кальций и фосфорный ангидрид, после чего сероводород поступает в трубу с окисью празеодима. Температуру в печи доводят до 1300 и при этой температуре пропускают сероводород в течение 5 часов. Затем печь охлаждают ( в токе сероводорода) до комнатной температуры и выгружают продукт сульфидирования. [10]
Гадолиния оксид ( окись гадолиния), хлорид ( хлористый гадолиний); гольмия оксид ( окись гольмия); диевропия диоксидсульфид ( оксисульфид европия); дииттрия диоксидсульфид ( оксисульфид иттрия); диспрозия оксид ( окись диспрозия), сульфид ( сернистый диспрозий), хлорид ( хлористый диспрозий); иттербия оксид ( окись иттербия); иттрия оксид ( окись иттрия), сульфид ( сернистый иттрий), фторид ( фтористый иттрий), хлорид ( хлористый иттрий); лантана гексаборид, нитрат гексагидрат ( шестиводный азотнокислый лантан), оксид ( окись лантана), сульфат ( сернокислый лантан), хлорид ( хлористый лантан); лютеция оксид ( окись лютеция), хлорид ( хлористый лютеций); неодима оксид ( окись неодима), хлорид ( хлористый неодим); празеодима ( III) оксид ( окись празеодима), хлорид ( хлористый празеодим); самария ( III) оксид ( окись самария); скандия нитрат ( азотнокислый скандий), оксид ( окись скандия); тулия оксид ( окись тулия); церия гексаборид, церия ( III) оксид ( окись церия), сульфид ( сернистый церий), фторид ( фтористый церий, флюоцерит - мин. IV) оксид ( двуокись церия, цериа-нит - мин. [11]
Двуокись церия оказалась хорошим катализатором в процессе гидрогенизации СО; она же способствует быстрому протеканию реакции дегидрогенизации спиртов. Окись празеодима Рг203 катализирует окисление аммиака при низких температурах. Такие процессы, как электрохимическое окисление анилина в хинон или превращение S0a в S03, в большой степени ускоряются в присутствии ионов церия. [12]
Большинство солей празеодима действительно светло-зеленые, а сам металл внешне не отличить от лантана и церия - белый, покрытый окисной пленкой. Правда, окись празеодима на окислы церия и лантана не похожа - ни по внешнему виду, ни по строению. [13]
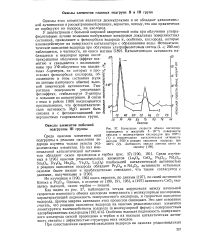
Как видно из рис. 37, наблюдается четкая корреляция между начальной скоростью изотопного обмена кислорода поверхности с молекулярным кислородом, характеризующей подвижность поверхностного кислорода, и скоростью окисления водорода, причем энергии активации этих процессов совпадают. Особенно высокая подвижность поверхностного кислорода окисей празеодима и тербия и их высокая каталитическая активность связаны с дефектностью структуры этих окислов. [15]
Страницы: 1 2