Окись - родий
Cтраница 2
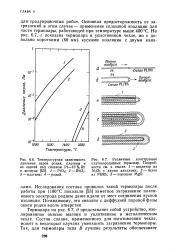
Прибавление к раствору, содержащему хлориды родия, небольшого количества едкого кали при нагревании вызывает выпадение лимонно-желтых гидратов окиси родия, которые растворяются в избытке щелочи, давая раствор, окрашенный в желтый цвет. Если к такому раствору прибавить несколько капель спирта, то при обыкновенной температуре образуется черный осадок металлического родия. [16]
Вещество, близкое по составу к оксалату родия, получали в виде аморфного, темно-желтого продукта при высушивании раствора свежеприготовленного гидрата окиси родия в концентрированном растворе щавелевой кислоты. [17]
Соединение описано Клаусом [11], который получил его при нагревании в течение часа до температуры красного каления смеси порошка металлического родия или гидрата окиси родия, едкого кали и калийной селитры. [18]
К концентрированному кипящему раствору КНС204, взятому в большем количестве ( 10 %), чем это требуется по расчету, прибавляют свежеосажденный гидрат окиси родия. [19]
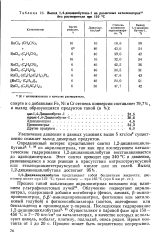 |
Выход 1 4-дицианобутена - 1 на различных катализаторах19 без растворителя при 110 С. [20] |
Последующее гидрирование 1 2 - дицианоциклобутана3 - 21 осуществляют в паровой фазе при 150 - 450 С и 7 - 70 кгс / см2 на катализаторах, в качестве которых используют никель, кобальт, платину, палладий, окись родия. [21]
Для его получения к раствору хлорродиата калия, подогретому до 30 С, добавляют по каплям, при интенсивном перемешивании, 30-процентный раствор КОН до перехода цвета раствора из розовато-желтого в светло-желтый. Осадок гидрата окиси родия светло-желтого цвета отфильтровывают, промывают водой и растворяют в серной кислоте. [22]
К 20 мл анализируемого раствора добавляют 10мл20 % - ного раствора гидроокиси натрия, перемешивают и медленно нагревают до кипения. При этом выделяется желтый осадок гидрата окиси родия. В горячий раствор вводят 20 мл 2 М раствора гипохлорита натрия, перемешивают, выпаривают при кипячении до - 30 мл; затем прекращают нагревание, добавляют ТШ мл холодной воды и 5 мг хлористого аммония, перемешивают до растворения последнего и вводят 10 мл раствора крахмала ( 5 г. л) и 2 г KJ. После растворения йодистого калия смесь осторожно вливают в 20 мл 50 % - ной НС1 и сразу же титруют выделившийся иод 0 05 N раствором гипосульфита натрия. Метод позволяет определять до 2 0 мг / мл родия. Определению мешают элементы, способные окислить J - до J2 ( Fe, Ni, Co, Cu, Pb, Mn), а также все платиновые металлы. [23]
К 20 мл анализируемого раствора добавляют 10 мл 20 % - ного раствора гидроокиси натрия, перемешивают и медленно нагревают до кипения. При этом выделяется желтый осадок гидрата окиси родия. В горячий раствор вводят 20 мл 2 М раствора гипохлорита натрия, перемешивают, выпаривают при кипячении до - 30 мл; затем прекращают нагревание, добавляют 100 мл холодной воды и 5 мг хлористого аммония, перемешивают до растворения последнего и вводят 10 мл раствора крахмала ( 5 г / л) и2г KJ. [24]
Исследования состава проволок такой термопары после работы при 1100 С показали [53] заметное загрязнение платинового электрода родием даже вдали от мест соединения кусков изоляции. По-видимому, это связано с диффузией паровой фазы окиси родия вдоль отверстия. [26]
Первая группа реагентов пригодна главным образом для количественного отделения родия и палладия. Вторая группа реагентов, получившая более широкое применение, обеспечивает количественное осаждение гидратов окисей родия ( IV) и иридия ( IV), обладающих меньшей растворимостью, чем гидраты окисей этих элементов в низших степенях окисления. Следует отметить, что увеличение концентрации ионов хлора, подавляющих гидролиз, сильно сказывается на условиях осаждения гидрата окиси палладия и резко повышает значение рН его количественного выделения. [27]
Первая группа реагентов пригодна главным образом для количественного отделения родия и палладия. Вторая группа реагентов, получившая более широкое применение, обеспечивает количественное осаждение гидратов окисей родия ( IV) и иридия ( IV) обладающих меньшей растворимостью, чем гидраты окисей этих элементов в низших степенях окисления. Следует отметить, что увеличение концентрации ионов хлора, подавляющих гидролиз, сильно сказывается на условиях осаждения гидрата окиси палладия и резко повышает значение рН его количественного выделения. [28]
Через некоторое время из раствора выделяется вишнево-красный осадок, представляющий собой смесь гидрата окиси родия и хлорородиата калия. После продолжительного времени или тотчас при нагревании жидкость над твердой фазой становится желтой, а в осадке остается гидрат окиси родия лимонно-желтого цвета. Осадок отфильтровывают и промывают холодной водой. [29]
В азотной кислоте металлический родий не растворяется. Клаус [1] получил нитрат родия Rh ( NO3) s, растворяя в азотной кислоте гидрат окиси родия. При выпаривании раствора остается белая с желтым оттенком аморфная масса, очень гигроскопичная, растворимая в воде и нерастворимая в спирте. Смешивая раствор нитрата родия с нитратами натрия, Берцелиус [2] получил темно-красные кристаллы, растворимые в воде и нерастворимые в спирте. [30]
Страницы: 1 2 3