Желтая окраска - комплекс
Cтраница 2
При значительном содержании титана он выпадает в осадок в аммиачной среде. Определению мешают ионы меди, никеля, кобальта и хрома. Желтая окраска сульфосалицилового комплекса железа не изменяется в течение шести месяцев. [16]
В стакан из жаростойкого стекла поместить 20 мл раствора двузамещенного фосфата калия, 50 мл раствора серной кислоты и 200 мл воды. Появляется желтая окраска комплекса. [17]
НШд в кипящих растворах меняется природа катодной реакции, и активирование стали 04XI8HI0 сопровождается бурным выделением с поверхности электрода Шо. Одновременно изменяется состав координационной сферы комплексных хлоридов хрома, что прослеживается по изменению окраски продуктов коррозии в растворе. В дальнейшем желтая окраска комплексов fCrCIgd OJg ] 0 переходит в характерную темно-зеленую. [18]
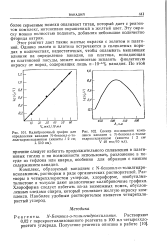 |
Калибровочный график для.| Спектр поглощения комплекса ванадия с М - бензоил-о-толил-гидроксиламином ( кюветы / 2 V 40 мкг / 10 мл. [19] |
Комплекс, образуемый ванадием с N-бензоил-о - толилгидро-ксиламином, растворим в ряде органических растворителей. Хлороформа следует избегать из-за возможных помех, обусловленных следами спирта, который усиливает желтую окраску комплекса. Наиболее удобным растворителем является четыреххло-ристый углерод. [20]
В фильтрате проверяют полноту осаждения фосфат - и арсенат-ионов. Для этого к 3 - 4 каплям фильтрата добавляют 10 - 15 капель хлорида циркония, встряхивают и нагревают. К фильтрату добавляют 3 - 4 капли насыщенного раствора молибдата аммония. При наличии силикат-иона появляется желтая окраска комплекса кремнемолибдата. К раствору крем-немолибдата добавляют 2 - 3 капли бензидина и затем 20 капель насыщенного раствора ацетата натрия. Желтая окраска переходит в синюю вследствие образования молибденовой и бензидиновой сини. [21]
Некоторые катионы металлов образуют настолько устойчивые комплексы с зриохром черным Т или кальмагитом, что ЭДТА не может вытеснить индикатор из этих комплексов. Поэтому в точке эквивалентности никакого изменения окраски не наблюдается, или если изменение окраски и происходит, то постепенно после добавления значительного избытка ЭДТА. Никель ( II), медь ( II) и титан ( IV) ведут себя таким образом. Однако никель ( II) и медь ( II) можно определить прямым титрованием с ЭДТА в аммиачной среде, если использовать в качестве металлохромного индикатора мурексид, точка эквивалентности в этом случае соответствует переходу желтой окраски комплекса металла с мурексидом в фиолетовую окраску свободных анионов индикатора. [22]
Хотя комплексонометрическое титрование железа благодаря тому, что оно может быть выполнено в кислых растворах, высокоселективно - комплексообразованию в этих условиях мешают только цирконий, торий, висмут, индий, таллий, скандий и ртуть, - этот метод определения не так часто используется по сравнению с комплексонометрическим определением других катионов. Это объясняется тем, что для определения железа давно известно большое число точных и относительно удобных объемных и фотометрических методов. Кроме того, при титровании железа ЭДТА с наиболее распространенными индикаторами из-за относительно низкой интенсивности окраски индикаторного комплекса ( е 103) изменение окраски не очень резкое по сравнению с другими комплексо-иометрическими методами. Прежде всего использование сильно разбавленных растворов ЭДТА приводит к снижению четкости перехода окраски в точке эквивалентности. При более высокой концентрации железа определению мешает желтая окраска комплекса железа с ЭДТА, потому что титрование приводит к обесцвечиванию комплекса железа с индикатором. Концентрация, при которой получают удовлетворительные результаты, колеблется от 10 до 50 мг железа на 100 мл раствора. Комплекс железа образуется сравнительно медленно, поэтому рекомендуют проводить титрование при - 60 С. [23]
Страницы: 1 2