Окружение - атом - металл
Cтраница 1
Окружение атома металла атомами азота и аналогичная система циклов встречаются в соединениях хлорофилла, гемоглобина и порфиринов. [1]
Если окружение атома металла имеет строго кубическую симметрию ( например, тетраэдрическую или октаэ-дрическую), наблюдается только контактный сдвиг. [2]
Близкое сходство окружения атомов металла в Мо-Fe - белках из различных источников вытекает из данных спектроскопии ЭПР для белков, полученных из С. [3]
Природа экранирования Me-Ме - взаимодействий при комплектном окружении атомов металла атомами неметалла обусловлена значительным перекрыванием de - орбиталей и сосредоточением максимальной плотности электронного облака в местах наибольшего сближения атомов неметалла. Вынужденный обмен электронами Me-Ме - связей и 252р - оболочек смежных Х - атомов возможен ( в соответствии с принципом Паули) только для электронов с, параллельной ориентацией спинов, что обусловливает стремление к взаимному удалению атомов неметалла. Me-Ме - взаимодействий, величина которого определяется природой ( включая размерные характеристики) атомов-компонентов, структурой кристалла и степенью его комплектности. Кроме того, следует допустить, что энергии Me-С -, С-С - и С - П - взаимодействий не зависят от концентрации и распределения вакансий ( П) [55], так как атомы углерода и вакансии в обсуждаемых фазах во всех случаях находятся в октаэдрическом окружении атомов металла, атомы углерода преимущественно электронейтральны и между партнерами развиваются лишь близкодействующие ( кулоновские и обменные) взаимодействия. [4]
Структурно изучены также производные Fe ( CO) s, в которых тригонально-бипирамидальное окружение атома металла не сохраняется. Этот факт указывает на частичную двоесвязность, обусловленную, по мнению авторов [105], dn - рп-взаимодействием металл-чтигавд по аналогии с СО-группами. Если считать, что координированные с Fe атомы N являются, как и СО-группы, двухэлектронными донорами, то атом металла приобретает устойчивую 18-электронную конфигурацию, как в пентакарбониле железа. [5]
Таким образом, подводя итоги рассмотрению производных пентакарбонила железа Fe ( CO) 5 с тригонально-бипирамидаль-ным окружением атома металла, следует отметить, что в них наблюдается как эквивалентность длин связей аксиальных и экваториальных карбонильных групп с атомом Fe, так и нарушение этой эквивалентности в ту или иную сторону. Следует отметить, что реальные значения длин связей и валентных углов в этих комплексах, как, впрочем, и других, определяются столь многими факторами ( cr - донорными и л-акцепторными, а также л-донорными и а-акцепторными свойствами лигандов, их стерическими эффектами), что на основании только анализа экспериментальных фактов не представляется возможным однозначно установить, как влияет замена СО-групп в Fe ( CO) 5 на характер связи атома Fe с оставшимися карбонильными группами. [6]
В процессе конденсации с образованием ванадат - и вольфрамат-изополианионов координационное число изменяется с 4 до 6 и появляется октаэд-рическое окружение атома металла шестью атомами кислорода. В итоге образуются дискретные полианионы, включающие несколько октаэдров, а затем - непрерывная структура оксидов. Когда имеет место соединение по ребрам, система может быть электростатически стабилизирована при небольшом искажении, заключающемся в некотором удалении атомов металла друг от друга. При росте степени конденсации раздвинуть все атомы металлов для снижения электростатического отталкивания становится все более трудно. В конце концов связывание по ребрам прекращается, поскольку сопровождающее его искажение становится чрезмерным. [7]
Ионы [ МоО ( ОН) 5 ] легко полимеризуются с образованием в растворе различных полианионов, в которых сохраняется ок-таэдрическое окружение атомов металла кислородными атомами. Формы полианионов несколько различны для молибдена и вольфрама ( наиболее характерны [ Mo7O24 ] e -, [ MogO2e ] 4 -, [ HW12O41 ] 10 - и [ WlzO3e ] 6) и зависят от рН и концентрации раствора. Внутри полимерных анионов имеются пустоты между отдельными октаэдрами МОв, они могут оставаться незанятыми, в таком случае мы имеем дело с изополианионами - полимерными анионами, построенными из атомов одного металла, в данном случае молибдена или вольфрама. Соответствующие кислоты, хорошо растворимые в воде, носят название изополи-кислот. [8]
 |
Координационные числа металла п азота в кристаллических нитридах. [9] |
В так называемых нитридах внедрения атомы металла почти ( а в некоторых случаях - точно) плотноупаковапы ( как, например, в ScN, YN, TiN, ZrN, VN и в нитридах редкоземельных элементов со структурой типа NaCl), но окружение атомов металла в этих соединениях обычно отлично от наблюдаемого в кристалле металла ( табл. 29.13, разд. Так как эти промежуточные нитриды и по физическим свойствам, и в структурном отношении имеют много общего с карбидами, а в несколько меньшей степени и с боридами, то их удобно рассмотреть вместе с этими соединениями в гл. [10]
 |
Кристаллические структуры гидроксогалогенидов М2Х ( ОН з. [11] |
Возможные структуры с гексагональной или кубической плот - нейшей упаковкой приведены вместе с примерами в табл. 10.15, которая соответствует разделу более общей табл. 4.6 с рубрикой / 2 занятых октаэдрических пустот. В идеальных плот-ноупакованных структурах окружение атома металла октаэдри-ческое ( 4ОН 2Х или 5ОН Х), причем связи М - О и М-X имеют их обычную длину. [12]
Только одна двойная связь тетраена конформации ванна тесно связана с каждым атомом меди; атомы углерода этой двойной связи находятся в той же плоскости, что и Си и соседние атомы хлора цепи. Так, в соединении [ нор - С7Н8СиС1 ] 4 осуществляется искаженное тригональное окружение атома металла. Расстояния между атомами углерода координированной двойной связи и медью составляют 2 073 и 2 097 А. Возможно еще и дополнительное слабое взаимодействие между металлом и двойной связью, не являющейся соседней по отношению к близко расположенной связи С С; эти длины связи Си-С равны 2 755 и 2 715 А соответственно. В строении соединений С8Н8 - СиС1 и C8H8 AgNO3 наблюдается существенная аналогия, так как в последнем соединении ионы серебра и NO - Г образуют длинные цепи в кристалле и снова только одна двойная связь циклооктатетраена прочно связана с металлом. [13]
Обнаружен ряд очень простых структур с z / xnl ( группа АИ), но наиболее интересны структуры группы AIII, которая в настоящее время представлена только двумя структурными типами галогенидов Sd-металлов. Хотя в этих структурах z / xnl, некоторые из координационных позиций в окружении атома металла заняты вместо воды атомами хлора. Соединений группы AIV просто не существует, так как все возможности уже исчерпаны, и при z / xn 1 катион либо полностью гидратирован, либо имеется избыток кристаллизационной воды. [14]
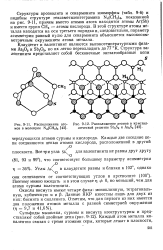 |
Расположение это - [ IMAGE ] - 12. Расположение атомов в кристал-мов в молекуле N4 ( CH2 e. лической решетке Sb2S3 и As2S3. [15] |
Страницы: 1 2