Оксигруппа
Cтраница 1
Оксигруппа в бромфталеиновом красном сопряжена с большой ненасыщенной системой, и поэтому окружение окси-группы очень сильно влияет на электронный спектр молекулы. Триэтиламмониевая соль - красная ( в углеводородах и ихгалогенпроизводных, в простых и сложных эфирах Ямакс около 5400 А), хотя в растворителях, более благоприятствующих ионной диссоциации, цвет изменяется до синего. [1]
Оксигруппы, находящиеся во внутримолекулярносвязан-ном состоянии, например в случае opmo - диокси - и вициналь-ных триоксигрупп или оксикарбонильных хелатных систем, проявляют меньшую активность в сорбционном процессе. Эггер [347] считает, что поскольку две оксигруппы в орто-положении или три вицинальных гидроксила выполняют роль приблизительно одной оксигруппы, то такие агликоны, как кемпферол, кверцетин и мирицетин будут проявлять аналогичные сорбционные свойства и не будут разделяться. Бан - дари [289] подтвердил, что, действительно, разделение кемп-ферола и кверцетина представляет собой очень трудную задачу. [2]
Оксигруппа в ( положении 1 аминогруппой не замещается вследствие влияния сульфогруппы, находящейся к ней в мета-положении. [3]
Оксигруппа в положении 6 настолько активирует ароматическое ядро, хроманов, что последние вступают в реакцию сочетания с солями диазония. К этой реакции способны - j - и 8-токоферолы, но не [ 3-токоферол. [4]
Оксигруппа - ОН способна в щелочной среде отдавать свой протон, вследствие чего у кислорода появляется дополнительная пара неподеленных электронов, также включающихся в общую систему зт-электронов. Электронодонорные свойства такого заместителя при этом усиливаются, и это приводит к тому же эффекту - сдвигу полосы поглощения в сторону длинных волн. Одновременно усиливается интенсивность поглощения. Однако ионизация может привести и к обратному эффекту, если она уничтожает указанные свойства групп. Так происходит, например, в тех случаях, когда ионизуется электронодонорная аминогруппа. [5]
Оксигруппы обозначены греческими буквами. [6]
Оксигруппы в положениях 2, 4 и 6 могут быть заменены при действии хлор-окиси фосфора или пятихлористбго фосфора на атомы хлора ( см. раздел о хлор-пиримидинах, стр. В жестких условиях может быть проведено ацилиро-вание; однако образующиеся О-ацильные производные, как и следовало ожидать, легко гидролизуются. [7]
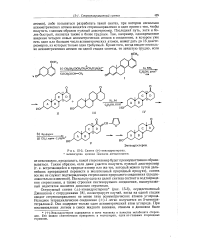 |
Синтез ( у-эпиандростерона. [8] |
Оксигруппа временно защищена дигидропираном. [9]
Оксигруппа, участвующая в образовании кислородного мостика, может находиться и в одном ядре с нитрозогру ппой, в орто - положении к последней. [10]
Оксигруппа, находящаяся в - положении, не способна образовать внутреннюю комплексную соль ( лак), но зато она в большей степени, чем а-оксигруппа антрахинона, склонна ксолеобразованию. [11]
Оксигруппа в положении 6 настолько активирует ароматическое ядро, хроманов, что последние вступают в реакцию сочетания с солями диазония. К этой реакции способны - j - и 8-токоферолы, но не [ 3-токоферол. [12]
Оксигруппа ослабляет связь с углеродным кольцом атома брома, стоящего в орто - и пара - положении по отношению к оксигруппе, что приводит к высокой реакционноспособности брома в момент выделения и перемещению его в другое положение. [13]
Оксигруппа вводится в молекулу различными путями: 1) плавлением сульфокислоты с едким натром. Этот метод часто называют кали-плавление; это название объясняется тем, что прежде применяли почти исключительно едкое кали. В настоящее время в огромном большинстве случаев используется более дешевый едкий натр. В зависимости от обстоятельств применяется разбавленная или концентрированная гидроокись. При работе с разбавленным NaOH ( 30 - 60 %), когда температура реакции выше температуры кипения, применяют автоклав. Давление совершенно не влияет на такие процессы, а является лишь нежелательным следствием температуры. [14]
Оксигруппа в положении 6 молекулы тетрациклинов также может быть удалена каталитическим гидрированием в присутствии Pd, но этот процесс, в отличие от предыдущего, проводят в кислой среде. Последняя реакция вообще легко протекает под влиянием кислот и является типичной особенностью гидроксильной группы при С6 тетрациклинов. Скорость этой реакции существенно зависит от природы заместителей при Сз, Су и, особенно, при Cg, достигая максимума в случае самого тетрациклина ( 1а) и минимума в случае 7-хлор - 6-деметилтетрациклина ( Id) ( периоды полудегидратации в 1 N H2SO4 при 100 соответственно равны 1 и 445 мин. [15]
Страницы: 1 2 3 4