Оксид - алюминий
Cтраница 1
Оксид алюминия А1203 растворяется в кислотах и растворах щелочей. После сильного прокаливания ( как и природный корунд) оксид алюминия в кислотах не растворяется, его сплавляют с пиро-сульфатом ( бисульфатом) калия или карбонатом натрия. При сплавлении в первом случае получается сульфат алюминия, во втором - алюминат натрия. [1]
Оксид алюминия белый с твердостью покрытия 1195 HV имеет температуру плавления 2320 К, обрабатывается шлифованием кругами из карбида кремния или алмаза. Покрытие является прекрасным диэлектриком, стойко к коррозии. [2]
Оксид алюминия голубой имеет твердость покрытия немного ниже, чем из белого корунда. Покрытие стойко к коррозии и абразивному воздействию, а также к изнашиванию в условиях трения при высоких температурах. [3]
Оксид алюминия Л12О повышает тугоплавкость, вязкость и температуру размягчения, поверхностное натяжение расплава стекла, улучшает механические свойства, теплопроводность, химическую стойкость, снижает ТКЛР. [4]
Оксид алюминия часто применяется в качестве носителя для катализаторов прямого окисления сероводорода. [5]
 |
Изобарно-изотермический потенциал оксидов. [6] |
Оксид алюминия ( III) при обычной и умеренно высоких температурах не восстанавливается до металлического алюминия такими химическими восстановителями как водород, углерод и большинство металлов. В табл. 2.2 приведены значения изо-барно-изотермического потенциала оксидов алюминия, водорода, углерода и таких активных металлов как натрий и магний. [7]
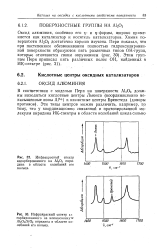 |
Инфракрасный спектр ад сорбированного на алюмосиликате AJjOs / SiOa пиридина в области колебаний его кольца. [8] |
Оксид алюминия, особенно его - у - и т - формы, широко применяется как катализатор и носитель катализаторов. Химия поверхности А1аОз достаточно хорошо изучена. [9]
Оксид алюминия активный, гамма-модификация окиси алюминия А12О3 - цилиндрики или шарики белого цвета ( возможен кремовый оттенок) с сильноразвитой поверхностью. Продукт получают, растворяя технический гидр-оксид алюминия в растворе едкого натра ( гидроксида натрия) и осаждая из образовавшегося раствора алюмината натрия подкислением азотной кислотой-гидроксид алюминия; осадок фильтруют, промывают, высушивают, размалывают, пептизируют азотной кислотой, формуют полученную тестообразную массу, сушат, измельчают, просеивают и прокаливают. Применяют для осушения масел и газов, а также как катализатор в процессах гидратации и дегидратации. [10]
Оксиды алюминия классифицируют либо по температуре, при которой их получают дегидратацией гидроксидов, либо по кристаллографической структуре. Во втором случае различают оксиды алюминия с гексагональными или кубическими плотноупакованными решетками. Представителем оксида алюминия с гексагональной решеткой является ое - А12О3, получающаяся при обжиге гидроксида алюминия при 1200 С. Оксиды алюминия с кубической решеткой получаются разложением байерита, нордстандита и бемита при низкой температуре ( г) - и у - А12О3) или. Идентификация модификаций оксидов и гидроксидов алюминия проводится рентгенографически. [11]
Оксид алюминия наиболее часто используют в качестве носителя, особенно для катализаторов глубокого окисления. Обычно оксид алюминия получают термическим дегидратированием различных модификаций гидроксида алюминия. Структура и свойства носителя сильно зависят от его генезиса и в первую очередь от природы исходного гидроксида и режима его дегидратации. [12]
Оксид алюминия амфотерен, его сорбционные свойства и активность зависят от Благосостояния. Удаляя адсорбированную воду, активируют оксид алюминия и достигают хорошего разделения газообразных углеводородов. [13]
Оксид алюминия в качестве катионита приготовляют растворением металлического алюминия в растворе NaOH, последующим осаждением двуокисью углерода и прокаливанием образовавшегося осадка. [14]
 |
Частица сульфированной смолы - катионита. [15] |
Страницы: 1 2 3 4