Оксид - литий
Cтраница 1
Оксид лития - очень слабый окислитель, с трудом и в незначительной степени восстанавливается энергичными восстановителями. [1]
Оксид лития стоит особняком, нарушая общую картину изменения свойств и приближаясь к окислам щелочноземельных металлов. [2]
Оксид лития Li2O получается непосредственным взаимодействием элементов. По химической природе Ы2О - основный оксид, а потому при взаимодействии с кислотными оксидами и кислотами образует соли. Так, Li20 легко поглощает С02 с образованием карбоната лития. [3]
Оксид лития гидратируется сравнительно медленно. Напротив, оксиды остальных щелочных металлов реагируют с водой весьма энергично. Взаимодействие протекает по схеме Э2О Н2О 2ЭОН и сопровождается большим выделением тепла. Непосредственного применения оксиды щелочных металлов не находят. [4]
Оксиды лития и натрия - белые вещества, оксид калия имеет светло-желтую окраску, рубидия - желтую, цезия - оранжевую. [5]
Оксид лития Li2O получается непосредственным взаимодействием металла и кислорода. По химической природе Li20 - основный о ссид, а потому при взаимодействии с кислотными оксидами и кислотами образует соли. Так, Li2O легко поглощает СО2 с образованием карбоната лития. [6]
Оксид лития Li O получается непосредственным взаимодействием металла и кислорода. По химической природе Li20 - основный сйссид, а потому при взаимодействии с кислотными оксидами и кислотами образует соли. Так, LiaO легко поглощает СОа с образованием карбоната лития. [7]
Добавление оксидов лития, магния к р - А12Оз приводит к увеличению проводимости и стабилизации последнего. [8]
Определяют сумму оксидов лития, натрия, калия, рубидия и цезия. Навеску ( 10 - 30 мг) средней пробы породы помещают в платиновый тигель объемом 3 - 5 мл, смачивают 2 каплями воды и добавляют 2 мл концентрированной плавиковой кислоты. Затем тигель покрывают крышкой и нагревают в течение 10 мин на кипящей водяной бане. Взмучивают содержимое тигля тонкой струей воды из промывалки и выпаривают досуха. Сухой остаток смачивают 2 мл концентрированной плавиковой кислоты и вновь выпаривают досуха. Смесь выпаривают досуха на водяной бане дважды и остаток нагревают еще 20 мин. Затем обтирают снаружи тигель кусочком фильтровальной бумаги и помещают его в сушильный шкаф, нагретый до 120 С, на 10 мин, после чего температуру повышают до 220 С. Операцию обработки щавелевой кислотой повторяют дважды. После этого остаток в тигле прокаливают в муфеле при 700 - 800 С. [9]
Прямым взаимодействием кислорода с щелочным металлом может быть получен только оксид лития. Остальные оксиды получают косвенным путем. [10]
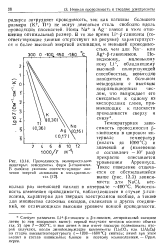 |
Проводимость монокристаллов уравнением Аопешп са некоторых замещенных форм ji - глинозема. j. r п j. [11] |
Следует различать и - р-глинозем и - глинозем, легированный оксидом лития ( о нем говорилось выше): первый получают методом ионного обмена ( гл. С, п ион лития в нем имеет высокую подвижность; второй получают, вводя литийсодержащие компоненты ( LijCOs или LiAl5O8) на стадии высокотемпературного ( - 1200 - 1600 С) синтеза; литий при этом ьхолит в состав шшшельных блоков и поэтому ммонолвпжеи. [12]
Представлялось интересным проследить, каким образом имеющийся в исходном гидроксиде алюминия оксид лития влияет на характер фазовых превращений в процессе прокаливания. В литературе [105-109] имеются сведения по изучению термических превращений ряда продуктов глиноземного производства, в том числе и гидроксида алюминия. [13]
Запасы асбеста, алмазов, оксида бора, пентоксида ванадия, оксида лития, оксида стронция, минеральных красок, мышьяка, меди, никеля, рассеянных элементов, редких земель, свинца, цинка, серебра, оксида циркония учитываются только до 0 1, остальных полезных ископаемых - с округлением до целых единиц. [14]
Взаимодействие лития с неочищенным водородом приводит к загрязнению гидрида кислородом ( оксидом лития) и часто сопровождается самовоспламенением металла. Поэтому при получении чистого гидрида лития водород нужно тщательно очистить от паров воды и кислорода, пропустив его через раскаленные магниевые стружки. [15]
Страницы: 1 2 3 4