Оксид - олово
Cтраница 3
Солнцезащитные, или теплозащитные, стекла получают путем нанесения на поверхность стекла пленок оксида олова с примесью оксида сурьмы Sb2Or Это стекло может иметь светопропускание от 75 до 45 % независимо от его толщины. Оно имеет цвет от серо-голубого до сине-фиолетового. [31]
Оксид олова ( II) SnO используют для изготовления эмали и для получения оксида олова ( IV) SnO2, который, в свою очередь, применяется в производстве некоторых видов силикатных материалов: эмалей, глазурей, керамики, молочного стекла и как абразив для полировки мягких поверхностей. [32]
Оксид олова ( П) SnO используют для изготовления эмали и для получения оксида олова ( 1У) SnO2, который, в свою очередь, применяется в производстве некоторых видов силикатных материалов: эмалей, глазурей, керамики, молочного стекла и как абразив для полировки мягких поверхностей. [33]
Для повышения активности катализатора V2O5 / TiO2 в качестве добавок к нему рекомендуют использовать оксиды олова, кремния, циркония, марганца, кобальта, хрома и редкоземельных элементов - лантана, иттрия. [34]
Оксид олова ( IV) очень стоек по отношению к кислотам и щелочам, а оксид олова ( II) легко растворим в кислотах. [35]
Токопроводящие стекла получают на основе оксидов олова, индия, цинка, и др. Чаще всего используют пленки оксида олова, модифицированного примесями сурьмы, фосфора, цинка, фтора и др. Эти пленки прозрачны, бесцветны, их удельное поверхностное сопротивление может быть от 10 Ом / см2 до 1 - Ю5 Ом / см2 и выше, толщина пленки не превышает 1 мкм. [36]
Из оксидов олова и свинца известны SnO, PbO и SnCb, PbO2, из которых наиболее устойчивыми являются оксид олова ( IV) и оксид свинца ( II), которые образуются при накаливании соответствующих металлов на воздухе. [37]
Чтобы получить пленку с золотым оттенком, применяют сульфид меди, сульфид серебра и оксиды железа, а с красным оттенком - добавляют оксид олова и сажу. [38]
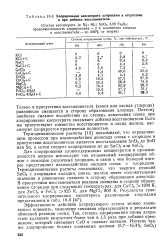 |
Хлорирование касситерита хлоридами в отсутствие и при добавке восстановителя. [39] |
Для хлорирования оловосодержащих концентратов в промышленности широко используют так называемый хлорирующий обжиг с помощью различных хлоридов, в связи с чем большой интерес представляет взаимодействие оксидов олова с хлоридами. Термодинамические расчеты показывают, что энергия реакций SnO2 с хлоридами кальция, цинка, железа имеет положительные значения и равновесие смещено в сторону образования диоксида. В присутствии восстановителя реакции смещены в сторону образования хлоридов при следующих температурах: для СаС12 51200 К, для ZnCl2 и FeCl2 925 К, для MgCl2 800 К. [40]
Для получения молочных, глухих стекол применяют фосфорно-кислые со ди ( особенно соли аммония и кальция), соединения фтора ( криолит, плавиковый шпат, кремнефтористый натрий), оксид олова, тальк и др. С помощью этих веществ можно получить как слабомолочные, лишь-слегка мутноватые ( опалесцирующие), так и совершенно белые стекла. [41]
В справочнике [48] приведены еще 8 бинарных оксидных систем, одним из компонентов которых является РЬО ( другой компонент - В203, А1203, Ge02 и др.), и ни одной бинарной системы с оксидами олова. [42]
К числу амфотерных окислов относятся оксид алюмт - - ния - А12О3, оксид хрома ( III) - Сг: гО3, оксид бериллия - ВеО, оксид цинка - ZnO, оксид свинца ( II) - РЬО, оксид олова ( II) - SnO и ряд других соединений. [43]
Символ: Sn; серебристо-белый, блестящий металл; имеет среднюю твердость, большую эластичность, при сгибании издает хрустящий звук ( оловянный крик); при комнатной температуре устойчив по отношению к воздуху и воде; при сильном нагревании сгорает ярким белым пламенем до оксида олова ( 1 /) SnOa; реагирует с разбавленными растворами сильных кислот с выделением водорода и образованием солей; при нагревании с растворами гидроксидов образуются соли оловянной кислоты - станнаяы и водород. [44]
Символ: Sn; серебристо-белый, блестящий металл; имеет среднюю твердость, большую эластичность, при сгибании издает хрустящий звук ( оловянный крик); при комнатной температуре устойчив по отношению к воздуху и воде; при сильном нагревании сгорает ярким белым пламенем до оксида олова ( 1 /) Sn02; реагирует с разбавленными растворами сильных кислот с выделением водорода и образованием солей; при нагревании с растворами гидроксидов образуются соли оловянной кислоты - станниты и водород. [45]
Страницы: 1 2 3 4