Оксид - цирконий
Cтраница 1
Оксид циркония является весьма стойким химическим соединением. Mo, W и Zr в инертной атмосфере и вакууме не взаимодействует до 173 К. С Nb слабое взаимодействие начинается с 1673 К. Взаимодействие с MgO начинается с 73 К, с А12О3 - с 1973 К. В контакте с графитом восстановление на-шается с 1873 К. [1]
Оксид циркония ( IV) растворяется в концентрированной серной, а также в плавиковой кислотах. [2]
Оксид циркония ZrOj растворяется в конц. Слабокислотный характер ZrOj проявляется также в способности коллоидного гидроксида Zr ( OH4 адсорбировать щелочи. [3]
Особенностью оксида циркония ( ZrO2) является слабокислотная или инертная природа, низкий коэффициент теплопроводности. Рекомендуемые температуры применения керамики из ZrO2 2000 - 2200 С; она используется для изготовления огнеупорных тиглей для плавки металлов и сплавов, как тепловая изоляция печей, аппаратов и реакторов, в качестве покрытия на металлах для защиты последних от действия температур. [4]
Серебро - оксид циркония -: микровыключатели, реле на токи от миллиампер до 100 А. [5]
Пуансоны из оксида циркония используются для выдавливания изделий как из черных, так и из цветных металлов; оксид циркония также используют для выстилки металлолитейных желобов, особенно используемых в процессах непрерывной разливки металлов. [6]
Окисление металла оксидами циркония, Диоксид циркония вводится в состав некоторых флюсов в виде циркона для частичной замены кремнезема как с целью снижения химической активности флюса, так и для получения определенных характеристик сварочного шлака. [7]
Оксид олова, оксид циркония и силикат циркония, оксид титана и мышьяковистый ангидрид могут быть добавлены в качестве глушителей. [8]
В щелочных средах, когда оксиды циркония ведут себя как катиониты, может иметь место нейтрализация оксо-ниевых - групп и образование связей с гидроксил-ионами. [9]
В щелочных средах, когда оксиды циркония ведут себя как катиониты, может иметь место нейтрализация оксо-ниевых групп и образование связей с гидроксил-ионами. [10]
Повышение щелочестойкости достигается увеличением содержания оксидов циркония и олова за счет кремнезема. [11]
Получают в электрических печах из оксида циркония и технического углерода; разлагается при контакте с водой или воздухом. Используется в производстве нитей для ламп. [12]
В статье рассмотрены особенности технологии детонационного напыления оксида циркония. Выявлены характеристики технологического процесса, влияющие на качество покрытия из порошковой смеси ZrO2 - Сг. [13]
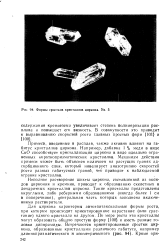 |
Формы сростков кристаллов циркона. Ув. 5. [14] |
Неполное растворение шихты циркона, составленной из оксидов циркония и кремния, приводит к образованию скелетных и дендритных кристаллов циркона. Такие кристаллы представлены округлыми, либо реберными образованиями ( иногда более 1 см в поперечнике), центральная часть которых заполнена включениями растворителя. [15]
Страницы: 1 2 3 4