Высший оксид - углерод
Cтраница 1
Высшие оксиды углерода и кремния - СО2 и SiO2 являются ангидридами кислот, которым отвечают слабые угольная и кремневые кислоты. Угольная кислота Н2СО3 существует в очень разбавленных растворах. Кремневые кислоты ( гидрат кремнезема xSiO2 - r / H2O) представляют собой смесь метакремневой H2SiO3, орто-кремневой H4SiO4 и поликремневых кислот. Низкомолекулярные формы кремневых кислот растворимы в воде и образуют коллоидные растворы, высокомолекулярные формы существуют в виде мало-растворимого в воде бесцветного студенистого осадка. Угольная кислота является более сильной, чем кремневая. Являясь двухосновной кислотой, она образует два типа солей - карбонаты и бикарбонаты. [1]
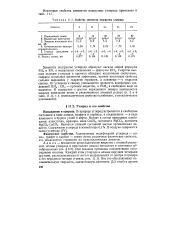 |
Свойства элементов подгруппы углерода. [2] |
Гидраты высших оксидов углерода и кремния обладают кислотными свойствами, гидраты остальных элементов амфотерны, причем кислотные свойства сильнее выражены у гидратов германия, а основные - у гидратов свинца. От углерода к свинцу уменьшается прочность водородных соединений RH4: СН4 - прочное вещество, а РЬН4 в свободном виде не выделено. [3]
Гидраты высших оксидов углерода и кремния обладают кислотными свойствами, гидраты остальных элементов амфотерлы, причем кислотные; свойства сильнее выражены у гидратов германия, а основные - у гидратов свинца. От углерода к свинцу уменьшается прочность водородных соединений RH. СН - прочное вещество, а РЬН в свободном виде не выделено. [4]
Гидраты высших оксидов углерода и кремния обладают кислотными свойствами, гидроксиды остальных элементов амфотерны, причем кислотные свойства сильнее выражены у германия, а основные - у свинца. От углерода к свинцу уменьшается прочность водородных соединений RH4: СН4 - прочное вещество, а РЬН4 - в свободном виде не выделено. [5]
 |
Свойства элементов подгруппы углерода. [6] |
Гидраты высших оксидов углерода и кремния обладают кислотными свойствами, гидраты остальных элементов амфотерны, причем кислотные свойства сильнее выражены у гидратов германия, а основные - у гидратов свинца. От углерода к свинцу уменьшается прочность водородных соединений RH4: СН4 - прочное вещество, а РЬН4 - в свободном виде не выделено. [7]
 |
Кристаллическая решетка алмаза. [8] |
Гидраты высших оксидов углерода и кремния обладают кислотными свойствами, гидраты остальных элементов амфотерны, причем кислотные свойства сильнее выражены у гидратов германия, а основные - у гидратов свинца. От углерода к свинцу уменьшается прочность водородных соединений RH4: CH4 - прочное вещество, а РЬН4 в свободном виде не выделено. [9]
Гидраты высших оксидов углерода и кремния обладают кислотными свойствами, гидраты остальных элементов амфотерны, причем кислотные свойства сильнее выражены у гидратов германия, а основные - у гидратов свинца. От углерода к свинцу уменьшается прочность водородных соединений RH4: СН4 - прочное вещество, а РЬН4 - в свободном виде не выделено. [10]
Гидраты высших оксидов углерода и кремния обладают кислотными свойствами, гидроксиды остальных элементов амфотерны, причем кислотные свойства сильнее выражены у германия, а основные - у свинца. От углерода к свинцу уменьшается прочность водородных соединений ЭН4: CHi - прочное вещество, а РЬН4 в свободном виде не выделен. [11]
Углекислый газ, или двуокись углерода, оксид С ( IV), высший оксид углерода, может находиться в газообразном, сжиженном и твердом ( в виде сухого льда) состояниях. Плотность двуокиси углерода зависит от давления, температуры и агрегатного состояния, в котором она находится. [12]
Переходя от углерода к его аналогу - кремнию, мы обнаруживаем резкое отличие в свойствах оксидов. Если высший оксид углерода при атмосферном давлении находится в газообразном состоянии при температурах выше - 78 С, то оксид кремния, напротив, представляет собой твердое при комнатной температуре вещество с температурой плавления выше 1700 С. [13]
Переходя от углерода к его аналогу - кремнию, мы обнаруживаем резкое отличие в свойствах оксидов. Если высший оксид углерода при атмосферном давлении находится в газообразном состоянии при температурах выше - 78 С, то оксид кремния, напротив, представляет собой твердое при комнатной температуре вещество с температурой плавления выше 1700 С. [14]
 |
Кристаллическая структура кубической модификации SiC2 ( / 3-кристобалит.| Кристаллическая структура тетрагональной модификации ТЮ2 ( структурный тип рутила. [15] |
Страницы: 1 2