Оксидаза - d-аминокислота
Cтраница 1
Оксидаза D-аминокислот с простетической группой ФАД [369] окисляет в соответствующие иминокислоты DL-лейцин, D - и DL-метионин, D - и DL-аланин, DL-a - аминомасляную кислоту. Оксидаза L-аминокислот, содержащая ФАД, дезаминирует L-аргинин в a - кето-б - гуанидовалериановую кислоту, L-орнитин в a - кето-б-аминовалериановую кислоту, L-лизин в г-кето-е-аминокапроновую кислоту. [1]
Оксидаза D-аминокислот в организме млекопитающих находится только в тканях печени и почек, причем активность ее в почках значительно выше, чем в печени. Фермент окисляет множество различных D-аминокислот и не проявляет поддающейся обнаружению активности по отношению к L-аминокисло-там. В связи с этим следует напомнить, что его используют для обнаружения ничтожных количеств D-аминокислот в присутствии высоких концентраций соответствующих L-изомеров ( стр. [2]
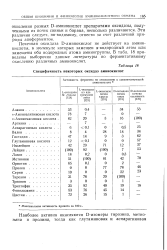 |
Специфичность некоторых оксидаз аминокислот. [3] |
Почечная оксидаза D-аминокислот не действует на аминокислоты, в молекуле которых замещен а-водородный атом или замещены оба водородных атома аминогруппы. В табл. 18 приведены выборочно данные литературы по ферментативному окислению различных аминокислот. [4]
Играет ли оксидаза D-аминокислот физиологическую роль и какова ее функция, пока не известно. [5]
Глицин окисляется оксидазой D-аминокислот, содержащейся в печени и почках млекопитающих. [6]
В связывании флавина с белком в оксидазе D-аминокислот и в липоамиддегидрогеназе [449] участвует рибитильная и аде-ниловая части ФАД; иминогруппа, по-видимому, остается свободной, так как эти ферменты обладают способностью к флуоресценции. [7]
Некоторые из этих соединений при испытании на оксидазе D-аминокислот обнаруживают частичную коферментную активность, характерную для ФАД. [8]
D-алло - Треонин окисляется быстрее, чем D-треонин, а D-изолейцин - быстрее, чем D-аугло-изолейцин. Подобное заключение вытекает также из того факта, что оксидаза D-аминокислот окисляет D - oc - аминофенилуксусную кислоту, не имеющую а-водородного атома. [9]
Фермент, катализирующий окисление D-аминокислот, был отделен от ферментной системы, осуществляющей окисление L-амино-кислот. В ряде более поздних исследований присутствие в почках и печени оксидазы D-аминокислот было подтверждено. Окислительное дезаминирование L-аминокислот, о котором сообщал Кребс, объясняется, вероятно, сочетанным действием транс-аминаз и дегидрогеназы глутаминовой кислоты ( стр. Получен, однако, ряд препаратов оксидаз L-аминокислот, и в существовании подобных ферментов едва ли можно сомневаться. [10]
Один из кристаллических промежуточных продуктов пурпурного цвета, выделенный Яги и др. [2-5] в анаэробных условиях из реакционной смеси оксидазы D-аминокислот, представляет собой, по-видимому, истинный фермент-субстратный аддитивный комплекс. Все данные убедительно свидетельствуют о том, что это так. [11]
D-ги-стидин усваивается крысами, но не мышами. D-триптофан не может быть использован для поддержания азотистого равновесия у человека, тогда как у крысы рост может обеспечиваться обоими изомерами. D-Изомеры фенил-аланина, тирозина, гистидина и метионина деза минируются очищенной оксидазой D-аминокислот ( стр. D-Треонин и D-лизин не используются для роста и не подвергаются действию оксидазы D-аминокислот. [12]
В одной из работ крысам вводили тяжелый изотоп азота в виде D-лейцина; количество включенного в белки N15 было примерно таким же, как и в случае кормления животных № 5 - Ь - лейцином. При введении D-лейцина, меченного дейтерием, некоторое количество дейтерия было найдено в тканевом L-лей-цине, что свидетельствует о частичном переходе углеродного остова D-лейцина в L-лейцин; это превращение предполагает инверсию конфигурации ас-углеродного атома. Очевидно, превращение D-лейцина в L-лейцин протекает со скоростью, недостаточной для обеспечения роста животных. По-видимому, D-аминокислоты дезаминируются оксидазой D-аминокислот с образованием соответствующих а-кетокислот и последние подвергаются переаминированию, превращаясь в соответствующие L-аминокислоты. [13]
Связь кофермента с апопротеином в флавопротеидных ферментах достаточно прочная, недиссоциирующая. Флавопротеиды расщепляются с различной степенью трудности с отделением апофермента и образованием рибофлавина или его коферментов. Однако простетическая группа в D-аспартатоксидазе отделяется уже в процессе очистки. В оксидазе L-ами-нокислот простетическая группа более прочно связана с апоферментом и диализ, а также повторное осаждение недостаточны для разрыва этой связи. Оксидаза D-аминокислот и дегидрогеназа восстановленного НАД ( цито-хром-с-редуктаза) диализируются на холоду разбавленной минеральной кислотой с выделением протеина. [14]
Активность многих высушенных змеиных ядов очень высока; Целлер нашел, что наибольшей активностью обладает яд Vipera aspis. Субстратная специфичность змеиной L-аминокислотной оксидазы указана в табл. 18; в относительных скоростях окисления отдельных аминокислот отмечены видовые особенности, хотя общие закономерности субстратной специфичности у разных видов сходны. Подобно D-аминокислотной оксидазе почек, этот фермент окисляет лизин и орнитин очень медленно, тогда как w - N-ацил-про - изводные этих аминокислот окисляются довольно быстро. Точно так же глутамин и аспарагин в отличие от соответствующих дикарбоновых аминокислот относительно быстро окисляются змеиной L-аминокислотной оксидазой. Оксидаза L-аминокислот в противоположность оксидазе D-аминокислот не окисляет про-лин, оксипролин и N-монометиламинокислоты. L-Изолейцин и L-алло-изолейцин окисляются ею в L - и D-формы а-кето-р-метил - валерьяновой кислоты без рацемизации в процессе окисления. Ферментативное окисление четырех изомеров изолейцина и двух L-стереоизомеров р-фенилсерина в оптически активные продукты лишний раз подтверждает, что р-водородный атом не вовлекается в процесс окисления ( см. стр. [15]
Страницы: 1 2