Оксинитрат
Cтраница 1
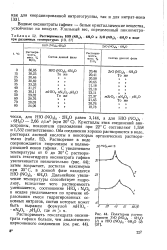 |
Растворимость HfO ( NO3 2. 6Н20 и ZrO ( NO3 2. 6H2O в воде при различных температурах [ 19, 37.| Политермы римости ZrO ( NO3 2 ( / и НЮ ( М03 2 6Н20. [1] |
Водные оксинитраты гафния - белые кристаллические вещества, устойчивые на воздухе. [2]
Разложение оксинитратов при нагревании завершается образованием гидроокиси алюминия [8], которая с повышением температуры разлагается с получением вначале бемита АЮОН, а затем окиси алюминия. [3]
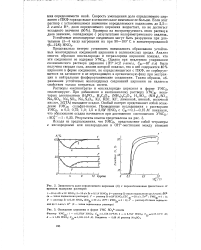 |
Зависимость доли определяемого циркония ( А с пирокатехиновым фиолетовым от времени выдержки растворов.| Осаждение циркония в форме УМС 5О42 - - ионом. [4] |
Растворы оксинитрата и оксихлорида циркония в форме УМСгг опалесцируют. [5]
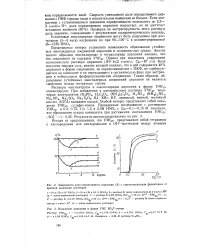 |
Зависимость доли определяемого циркония ( Л с пирокатехиновым фиолетовым от времени выдержки растворов.| Осаждение циркония в форме УМС 5О42 - ионом. [6] |
Растворы оксинитрата и оксихлорида циркония в форме УМС2г опалесцируют. При добавлении к азбтнокислому раствору УМС2г некоторых электролитов ( Н3РО4, Н2С2О4, ( NH4) 2C2O4, H2SO4, ( NH4) 2SO4, Na2SO4, Na2SO3, Na2S2O3, KJ, KBr, KF, лимонной, винной, молочной кислот, ЭДТА) выпадают осадки. Особый интерес представляет собой осаждение УМС2г сульфат-ионом. [7]
Дигидраты оксинитратов циркония и гафния с небольшим количеством воды образуют гексагидраты Zr ( Hf) O ( NO3) 2 - 6H2O, хорошо растворимые в воде. Это очень гигроскопичное и быстро гидролизующееся соединение. Дегидратация ди - и гексагидратов оксинитратов циркония и гафния гачинается при 40 и сопровождается частичным их разложением. Процесс дегидратации характеризуется отсутствием четких границ существования отдельных гидратов и соединений с различным соотношением NO3: Zr, что, как и поведение их в растворах, указывает на полимерную структуру. [8]
 |
Растворимость ( вес. % НЮ2 НЮ ( М03 2 - 2Н20 и HfO ( NO3 2 6Н3О в органических растворителях при 20 - 30 С. [9] |
Обезвоживание шестиводного оксинитрата начинается при 40 С, в интервале температур 80 - 130 С удаляются четыре молекулы кристаллизационной воды и образуется дигидрат оксинитрата. Дальнейшее нагревание сопровождается как потерей воды, так и частичным разложением соединения, приводящим к образованию дигафнилнитрата Ш2О3 ( NO3) 2 Н2О при 240 С. [10]
Оксихлорид и оксинитрат циркония идут на приготовление катализаторов в производстве бутадиена из спирта и др. Двойные основные сульфаты циркония успешно применяются в качестве дубителей кож. Фтороцирконат калия используют в производстве лигатур некоторых цветных металлов. [11]
В органических растворителях оксинитраты гафния менее растворимы, чем оксинитраты циркония. Лучшей растворяющей способностью обладают спирты и ацетон. [12]
Для приготовления исходных растворов применяли оксинитрат циркония, содержащий 1 5 - 2 1 % гафния по отношению к сумме двуокисей. [13]
Растворяют 1 70 г моногидрата оксинитрата висмута ( III) ( BiONOs-HzO) в 20 мл ледяной уксусной кислоты и разбавляют водой до 100 мл. Растворяют 65 0 г иодида калия ( KJ) в 200 мл воды. Смешивают оба раствора в мерной колбе вместимостью 1 л, добавляют 200 мл ледяной уксусной кислоты и доливают водой до метки. [14]
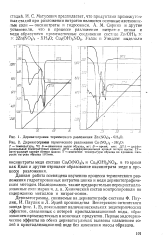 |
Дериватограмма термического разложения Zn ( NO3 2 6Н2О. [ IMAGE ] Дериватограмма термического разложения Си ( NO3. 2 ЗН2О. [15] |
Страницы: 1 2 3 4