Определение - термодинамические свойство
Cтраница 2
 |
Виды диаграмм равновесия в системах типа жидкость. [16] |
Большие отклонения от идеального поведения и сложность определения термодинамических свойств компонентов конденсированных фаз затрудняют применение термодинамических закономерностей для расчета условий фазового равновесия в рассматриваемых системах. Поэтому обычно исследование ведется экспериментально. [17]
Необходимо отметить, что в опытах по определению термодинамических свойств веществ довольно часто измерения температуры, давления и другие прямые измерения осуществляют в состоянии, когда ни температура, ни давление не меняются. [18]
В последнее время проведена большая работа по определению термодинамических свойств гидридов. [19]
 |
Поворотные изомеры 1 2-ди. [20] |
Изучение поворотной изомерии очень важно с точки зрения определения термодинамических свойств молекул, теории строения макромолекул [197, 198], а также для выяснения вопросов, связанных с механизмом и скоростью реакций. [21]
Таким образом, в области критических температур задача определения термодинамических свойств простого кристалла сводится к рассмотрению термодинамики одиночного осциллятора с собственной частотой колебаний, соответствующей максимальной частоте колебаний решетки. Более подробно о расчете термодинамических характеристик ангармонического осциллятора см. в гл. В полученном выражении для Тс связь с конкретным типом решетки выражается только через число ближайших соседей. [22]
Автор работы [4], используя методику восстановления Н2 для определения термодинамических свойств сульфидов ZT, показал, что ZrS2 при 500 - 900 С существует в диапазоне 65 6 - 66 6 % ( ат. [23]
Уравнение состояния Бенедикта является наиболее точным из известных способов определения термодинамических свойств легких углеводородов. Это уравнение слишком сложно, чтобы применять его для непосредственных расчетов равновесия пар - жидкость; для каждой данной серии условий необходимо решать методом последовательных приближений систему нелинейных уравнений. На этих графиках для ряда постоянных давлений приводятся два коэффициента в виде функции температуры и среднемоль-ной температуры кипения паровой и жидкой фаз. [24]
В первых двух главах этой книги были описаны методы определения термодинамических свойств газообразных продуктов горения и рассмотрено применение их для определения характеристических параметров рабочего тела, состоящего из этих продуктов. [25]
В Московском энергетическом институте проводятся аналогичные экспериментальные работы по определению термодинамических свойств пара. Здесь же группой научных работников МЭИ ( М. П. Вукаловичем, И. И. Новиковым, В. А. Кириллиным, В. Н. Зубаревым, А. Е. Шейндлиным, Л. И. Румянцевым и др.) проводятся работы по теоретическому исследованию термодинамических свойств водяного пара. В Московском энергетическом институте в 1937 г. на основе научных представлений получено уравнение состояния водяного пара. Большая часть точек в пределах проведенных экспериментальных работ получена расчетным путем. Это обстоятельство не явилось случайностью и основано на глубоком анализе предшествующих теоретических и экспериментальных работ, проведенных как в Советском Союзе, так и за рубежом. [26]
 |
Зависимость от состава активности СвН9 в бензольном растворе силиконов разного молекулярного веса. [27] |
Поскольку теплота образования растворов высокомолекулярных веществ имеет второстепенное значение для определения термодинамических свойств этих растворов, статистическая теория их разрабатывается в основном для крайнего случая атермальных растворов ( в которых ДЯР0) с введением поправок, учитывающих небольшие тепловые эффекты и использующих теорию регулярных растворов. [28]
Однако понятие температуры, чуждое механике и столь важное для определения термодинамических свойств, вводится при помощи представлений о наиболее вероятном распределении частиц по ячейкам фазового пространства как обратная величина неопределенного множителя в методе Лагранжа. [29]
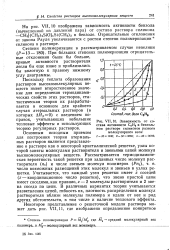 |
Зависимость от состава активности С6Н8 в бензольном растворе силиконов разного молекулярного веса. [30] |
Страницы: 1 2 3 4