Определение - теплоемкость
Cтраница 2
Определение теплоемкости продуктов сгорания на основании табличных данных как смеси ряда компонентов можно упростить, учитывая, что применяемые в дизелях сорта топлива имеют примерно одинаковый элементарный состав. [16]
Определение теплоемкости нефтяных остатков сопряжено с-рядом экспериментальных трудностей. Они заключаются в том, что в процессе нагрева до 700 С нефтяные остатки переходят в жидкое состояние и бурно кипят с интенсивным разбрызгиванием. Проведение экспериментов также осложняется значительной потерей массы образца в процессе нагрева. В качестве инертного материала был использован прокаленный и обессеренный кокс. [17]
Определение теплоемкости порошков пластических масс должно производиться калориметрическим методом, обеспечивающим получение надежных результатов. [18]
Для определения теплоемкости для образца создается переходный режим. [19]
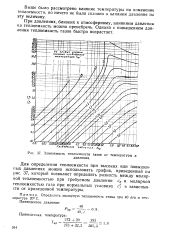 |
Зависимость теплоемкости газов от температуры и давления. [20] |
Для определения теплоемкости при высоких или повышенных давлениях можно использовать график, приведенный на рис. 37, который позволяет определить разность между молярной теплоемкостью при требуемом давлении ср и молярной теплоемкостью газа при нормальных условиях с в зависимости от приведенной температуры. [21]
Из определения теплоемкости следует, что при адиабатном процессе, когда AQ - О, теплоемкость равна нулю. [22]
Из определения теплоемкости ясно, что теплоемкость тела выражается в Дж / К. Соответственно этому удельная теплоемкость измеряется в Дж / кг - К, а молярная - в Дж / моль - К. [23]
Для определения теплоемкости при атмосферном давлении нужно внести поправку на изменение теплоемкости с изменением давления от 0 до 1 атм. Теплоемкости в широком интервале температур известны лишь для немногих веществ. Во многих случаях приходится вычислять теплоемкость для нужней температуры. Эти вычисления производятся, если возможно, по теоретическим уравнениям, но чаще - по ранее приведенным эмпирическим формулам. [24]
Это определение теплоемкости является общим и может быть применено к любой системе, состоящей из одного или из многих компонентов и из одной или из нескольких фаз. В физической химии обычно имеют дело с теплоемкостями веществ, фазовое состояние которых известно, поэтому в дальнейшем, если не будет оговорено противоположное, под теплоемкостью вещества мы будем подразумевать теплоемкость однофазной системы, состоящей из одного компонента. [25]
Такое определение теплоемкости неполно, поскольку дает неоднозначное представление о теплоемкости. Теплоемкость является функцией процесса системы, ибо количество тепла 6Q, требуемое для изменения температуры тела на dT, зависит от условий, при которых это тепло сообщается телу. Так что одна и та же система может иметь разные теплоемкости в зависимости от процесса передачи тепла и, вообще говоря, 0 С - foo. Например, при изотермическом процессе ( dT - 0) С оо, а при изэнтропическом обратимом процессе ( dS 0) теплоемкость того же тела равна нулю. В термодинамике тело с бесконечной теплоемкостью называют термостатом. Температура термостата не меняется при теплообмене с другими телами. [26]
Такое определение теплоемкости неоднозначно. Неоднозначность теплоемкости в уравнении ( 5 2) обусловлена тем фактом, что BQ не является полным дифференциалом. В зависимости от условий опыта теплоемкость может изменяться от - оо до оо. [27]
Из определения теплоемкости следует, что один и тот же газ может иметь бесчисленное множество теплоемкостей в зависимости от термодинамического процесса, при котором осуществляется теплообмен. [28]
Для определения теплоемкости сначала находится средняя температура по сечению для каждого момента времени как среднеарифметическая из температуры оси и на образующей образца. [29]
Из определения теплоемкости следует, что один и тот же газ может иметь бесчисленное множество теплоемкостей в зависимости от термодинамического процесса, при котором осуществляется теплообмен. [30]
Страницы: 1 2 3 4