Бихро-мат
Cтраница 1
 |
Влияние нагревания на. [1] |
Растворы бихро-матов в результате гидролиза имеют кислую реакцию и образуют хромат-ионы. Поэтому при добавке кислоты равновесие смещается влево, а при добавке щелочи - вправо. [2]
 |
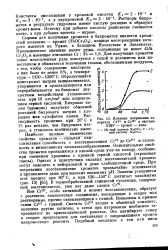
Влияние бихромата калия на катодную поляризацию железа в буферной смеси 0 025 г / л NaCl 0 057 г / л Na2S04 0 530 г / л Na2C03 0 420 г / л NaHC03 ( РН 9. [3] |
Хроматы и бихро-маты, несмотря на то что относятся к окислителям и, кажется, могли бы увеличить эффективность катодного процесса, не проявляют этих свойств в нейтральных электролитах. На рис. 2 5 представлены гальваностатические катодные поляризационные кривые, полученные в буферном растворе ( рН 9), содержащем различные концентрации бихрома-та калия. [4]
Анодными ингибиторами являются соли бихро-мата. В работающем элементе благотворность воздействия бихромата остается, однако, под сомнением. [5]
По-видимому, оптимальная концентрация добавок бихро-мата не может быть найдена только с учетом износа графитовых анодов и потерь кислородных соединений хлора из-за восстановления на катоде. [6]
Работами ВНИИСИНЖа показана возможность замены бихро-мата аммония техническим хромовым ангидридом при сохранении всех свойств катализатора. [7]
Для обнаружения перекисей растворяют кристалл бихро-мата натрия в I мл воды, добавляют каплю разбавленной серной кислоты, 2 мл эфира и встряхивают. Синее окрашивание эфирного слоя ( перхромат) указывает на присутствие в нем перекисей. Чтобы удалить перекиси, эфир встряхивают с 5 % - ньм раствором сернокислого ( закисного) железа, подкисленного серной кислотой. После промывки водой такой эфир пригоден для экстракции. [8]
Уэбстер и Гальперн [13 - 15] изучали восстановление бихро-мата молекулярным водородом. Оказалось, что соли меди и серебра катализируют эту реакцию. Кинетическое исследование показало, что при этом протекает несколько реакций. [9]
В промышленности теперь в качестве окислителя применяют бихро-мат и серную кислоту. [10]
Чаще всего применяют окислительные смеси, например бихро-мат натрия или калия с серной кислотой, х ромовый ангидрил в уксусной или серной кислоте или в пиридине. Этому методу следует отдать предпочтение, если отсутствуют другие легко окисляющиеся функциональные группы или если реакцию проводят в небольшом масштабе. [11]
Поэтому, несмотря на интенсивную окраску ионов бихро-мата, необходимо применять индикатор; в качестве индикатора обычно берут дифениламин или фенилантраниловую кислоту. [12]
Окислителем обычно является хромовая смесь - раствор бихро-мата натрия или калия в серной кислоте. Очень часто окисление ведут кислородом воздуха в присутствии металлических катализаторов. [13]
Как видно из сказанного, способ получения бихро-мата натрия анодным растворением феррохрома очень прост и лишен многих недостатков, свойственных химическому способу. [14]
Хромовый ангидрид обычно растворяют в уксусной кислоте, бихро-маты - в разбавленной серной кислоте. В качестве растворителя для органических соединений рекомендуется ледяная уксусная кислота. Окисление проводят как на холоду, так и при нагревании. Окрашивание реакционной смеси в зеленый цвет указывает на окончание реакции. [15]
Страницы: 1 2 3 4