Блокирование - группа
Cтраница 1
Блокирование боковых N-карбокснамидных групп аспарагнна и глутамнна в пептидном синтезе применяется сравнительно редко. [1]
Для блокирования 5 -гидроксильных групп обычно используют производные трифенилметана, которые легко удаляются действием кислот, в том числе и апротониых кислот Льюиса. [2]
Все описанные реакции вызывают блокирование метилоль-ной группы; это или ограничивает увеличение молекулярного веса, или же способствует его увеличению, в зависимости от того, используются ли для этого блокирования монофункциональные или полифункциональные соединения. Например, реакция с одноосновной кислотой ограничивает дальнейший рост молекулы феноло-формальдегидной смолы; реакция с кислотной группой, входящей в молекулу алкидной смолы, способствует этому росту. [3]
При реакции переэтерификации ДМТ благодаря блокированию групп СООН такое автокаталитическое ускорение реакции, естественно, не имеет места. [4]
Чаще всего а синтезе олигонуклеотидов для блокирования 5 -гидрок-сильных групп используются монометокси - и диметокситрифенилметильные производные. Это связано с тем, что образуемые ими эфиры с нуклеозидами гидролизуются в значительно более мягких условиях, чем трифенилметильные. Деблокирование проходит под действием кислот. Введение каждой метоксигруппы ускоряет процесс примерно в 10 раз, что существенно снижает побочные эффекты при синтезе олигонуклеотидов. [5]
Большую роль в придании водостойкости играют также процессы блокирования групп ОН в наиболее рыхлых ( аморфных) областях волокна и кристаллизационные процессы, протекающие особенно интенсивно при термовытяжке. [6]
Подобным же образом, не существует специфического метода блокирования индольной группы в остатке триптофана. Остаток триптофана - препятствует определению числа незамещенных ти розильных остатков, проводимому по методу Фолина. Амидные группы также энергично реагируют с формальдегидом в щелочной среде, но по отношению к другим реагентам они инертны. До сих пор нет указаний на то, являются ли индольные и амидные группы существенными для проявления биологической активности белков. [7]
Поскольку флороглюцин имеет три реакционные группы, неспособность лигнина растворяться при нормальной бисульфит-ной варке может являться результатом блокирования реакционных групп в лигнине или образования межмолекулярных мостиков за счет трех функциональных групп фенола. [8]
При введении в слабокислую осадительную ванну или в вискозу небольших количеств формальдегида значительно замедляется реакция разложения ксантогената целлюлозы, что, по-видимому, связано с временным блокированием дитиокарбоновых групп ксантогената целлюлозы. [9]
Уолд и Броун [12] установили, что при обесцвечивании родопсина в его белковом компоненте освобождаются свободные группы SH; они нашли также, что синтез родопсина из ретинена и опсина можно затормозить путем блокирования групп SHn-ртутьхлорбен-зоатом. Авторы полагают, что ретинен связан с белком через серу. [10]
По аналогии с поведением 2-метилциклогексанона можно ожидать, что при метилировании а-декалона I атаке предпочтительно будет подвергаться атом водорода в положении 9, но прямое алкилирование приводит к образованию в качестве главного продукта 2-метильного производного. Различные косвенные методы алкилирования у Сд включают блокирование 2-метиленовой группы. По одному из методов ( Джонсон, 1947) конденсируют кетон I с этилформиатом и оксиметиленовое производное II превращают в О-изопропильное производное III путем алкилирования йодистым изопропилом. В приведенном случае соединение II образует С-алкильное производное при действии йодистого метила и О-алкильное производное - при действии йодистого изо-пропила. [11]
Полиформальдегид получается также полимеризацией триоксана ( твердого циклического тримера формальдегида) в присутствии инициаторов ионного ( катионного) типа. Триоксан нетоксичен, устойчив при хранении и может быть очищен обычными методами. Однако в промышленности полимеризация триоксана затруднена вследствие необходимости блокирования концевых полуацетальных групп. [12]
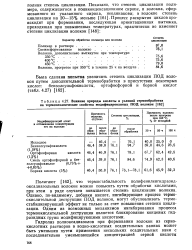 |
Влияние природы кислоты и условий термообработки на термомеханические свойства модифицированных ПОД волокон. [13] |
Полагают [162], что термостабильность полифениленгидразид-оксадиазольных волокон можно повысить путем обработки кислотами, при этом в ряде случаев повышается степень циклизации волокна. Однако, по-видимому, добавки кислот, ингибирующие процесс термоокислительной деструкции ПОД волокон, могут обусловливать термо-стабилизирующий эффект не только за счет повышения степени циклизации. Одним из возможных механизмов ингибирования процесса термоокислительной деструкции является блокирование концевых гид-разидных групп модифицирующими кислотами. [14]
При этом она также предпочтительно силилирует первичную гидроксильную группу. В присутствии избытка силилирующего агента образуется смесь 2 5 - и 3 5 -дисилильных производных. В зависимости от условий реакции и природы гетероциклического основания количество 2 5 -изомера равно или больше, чем количество 3 5 -дисшшльного производного. Такое направление реакции полезно при синтезе рибонуклеотидов, для которых требуется блокирование 2 -гидроксильной группы, но наличие свободной З - гидроксилыюй группы для образования фосфодиэфирной связи. [15]
Страницы: 1 2