Пентафторид - ниобий
Cтраница 1
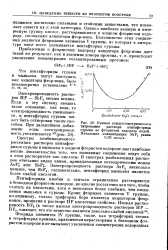 |
Кривая кондуктометрическог. [1] |
Пентафториды ниобия и тантала ограниченно растворяются в безводном фтористом водороде, но вполне достаточно для того, чтобы считать их кислотами, хотя и несколько более слабыми, чем соединения мышьяка и сурьмы. Кроме фторидов элементов V группы, по-видимому, только трифторид бора является акцептором фтор-ионов, проявляя в растворе HF кислотные свойства. [2]
Пентафторид ниобия NbF5 получается прямым действием сухого фтора на нагретый до 300 ниобий или взаимодействием между NbCl 5 и безводным HF. Возогнанный в вакууме NbF5 получается в виде бесцветных моноклинических призм. Получены многие соли обеих названных кислот. [3]
Пентафториды ниобия и тантала - сильные льюисовы кислоты, они катализируют реакции Фриделя-Крафтса и образуют аддукты с самыми различными нейтральными и анионными лигандами. В отличие от подобных реакций других пентагалогенидов ниобия и тантала эти реакции, как правило, являются реакциями присоединения; замещение галогена в молекуле пентафторида или изменение валентности центрального атома металла происходит редко. [4]
Пентафторид ниобия не образует аддукта с двуокисью серы. [5]
Пентафториды ниобия и тантала энергично растворяются в воде с выделением тепла. Растворы прозрачны, но при длительном стоянии или кипячении, а также при нейтрализации щелочью из них выпадают нерастворимые продукты гидролиза. [6]
Пентафториды ниобия и тантала образуют двойные соли с большинством фторидов ионного типа. Эти соли могут быть получены при непосредственном взаимодействии компонентов в расплаве или в водном растворе, но обычно их получают, добавляя щелочь или фторид щелочного металла в нужном соотношении к раствору гидроокиси в водной плавиковой кислоте. [7]
Пентафторид ниобия NbFs получается прямым действием сухого фтора на нагретый до 300 ниобий или взаимодействием между пентахлоридом ниобия и безводным фтористым водородом. Возогнанный в вакууме пента-фторид получается в виде бесцветных моноклинических призм. Если внести NbFs в среду фтористоводородной кислоты высокой концентрации, то образуется фторониобиевая кислота FbNbF. Получены многие соли обеих названных кислот. [8]
Диметисульфоксид реагирует с пентафторидами ниобия и тантала, образуя аддукты NbF5 - 2 ( CH3) 2 SO и TaF5 - 2 ( CH3) 2 SO, плавящиеся без разложения при 44 и 63 5 С соответственно. [9]
 |
Прибор для получения пентафторидов. [10] |
Этот метод описан пока только для пентафторида ниобия. Смесь порошкообразных реагентов нагревают в атмосфере аргона в молибденовом тигле, помещенном в реактор из инконеля. Реакция протекает при температуре 375 - 500 С. [11]
Изучение фосфидов, арсенидов, висмутидов и пентафторидов ниобия и тетра-фторида титана. [12]
Анализ возможных путей происхождения ионов показывает, что пары пентафторидов ниобия и тантала практически нацело ассоциированы, причем преобладает тримерная форма; однако зарегистрированы тетра - и пентамер. Теплота сублимации для процессов 3 [ MF6 ] - - ( M3F16) составляет 94 4 кДж / моль. [13]
В оригинале, очевидно, по ошибке для температур плавления и ки-яения пентафторида ниобия указаны величины соответственно 17 и 35 С. [14]
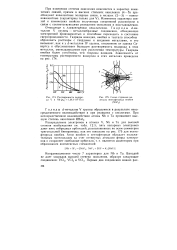 |
Растворимость водорода V и Nb ( pHi 1 013 - 105 Па.| Схема строения молекулы пентафторида ниобия ( NbF5. [15] |
Страницы: 1 2