Пентафторид - ниобий
Cтраница 2
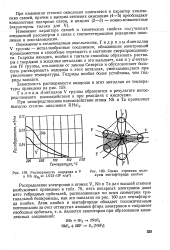
Распределение электронов в атомах V, Nb и Та для высшей степени возбуждения см. табл. 12.3; пять непарных электронов дают пять гибридных орбиталей, расположенных по осям симметрии тригональной бипирамиды, как это показано на рис. 175 для пентафторида ниобия. [16]
 |
Растворимость водорода в V и Nb 0 н Х X 10 Па.| Схема строения молекулы пентафторида ниобия. [17] |
Распределение электронов в атомах V, Nb и Та для высшей степени возбуждения см. табл. 67; пять непарных электронов дают пять гибридных орбиталей, расположенных по осям симметрии три-гональной бипирамиды, как это показано на рис. 175 для пентафторида ниобия. [18]
 |
Растворимость водорода в V [ IMAGE ] Схема строения моле-и Nb ( Рн2 - 1 s H. MZ кулы пентафторида ниобия. [19] |
Распределение электронов в атомах V, Nb и Та для высшей степени возбуждения приведено в табл. 70, пять непарных электронов дают пять гибридных орбиталей, расположенных по осям симметрии три-гональной бипирамиды, как это показано на рис. 160 для пентафторида ниобия. [20]
При этом она получается равной - 341 4 ккал / моль. Теплота образования кристаллических пентафторидов ниобия и тантала определена прямым методом 141 42 ]: ЛЯ / 298 ( NbF5, кр. В работе Амосова [43], посвященной обзору термохимических свойств галидов ниобия и тантала, теплота образования пентафторидов ниобия и тантала оценена сравнительным: методом. Полученные им значения весьма далеки от экспериментальных величин. [21]
Комплексные фтор окис лоты и их соли. Земельные кислоты легко растворимы во фтористоводородной кислоте с образованием комплексных фторокислот, производных пентафторидов ниобия и тантала. Эти комплексные кислоты нестойки и не могут быть выделены, но они дают прочные кристаллические соли аммония и щелочных металлов, из которых наиболее важны калиевые соли. При кипячении разбавленного нейтрального раствора фторотанталата калия медленно образуется белый осадок основной соли. Фторониобат калия K2NbF7 изоморфен с соответствующим фторотанталатом, но обладает значительно большей растворимостью в присутствии фтористоводородной кислоты. В разбавленных кислых растворах гидролизуется с образованием фтороксишюбата K2NbOF5, который выделяется в форме тонких моноклинных лластинок; растворимость фтороксиниобата составляет 8 г в 100 мл 1 % - ной фтористоводородной кислоты. Классический метод Мариньяка для отделения тантала от ниобия, который до сих пор применяется при извлечении металлов из их руд, основан на значительной разнице в величинах растворимости фторотанталатов и фтороксиниобатов. Аммонийные соли, соответствующие описанным выше трем калийным солям, при хроматографическом разделении метплэтилкегоном в колонке с целлюлозой ведут себя различно. Нормальные соли вымываются смесью кетона с фтористоводородной кислотой, содержащей 15 % 48 % - ной HF, а та же смесь, но с содержанием 1 % фтористоводородной кислоты, вымывает только нормальную соль тантала. Соль ниобия в результате гидролиза переходит во фторокси-ниобат, который не извлекается растворителем. [22]
Это соединение относится к первой из указанных выше групп. Но наиболее удобным методом получения является транспортная реакция между металлическим ниобием и пентафторидом ниобия. Ниобиевую фольгу помещают в один конец толстостенной никелевой трубки в атмосфере аргона, а в противоположный ее конец - избыток пентафторида ниобия. [23]
Первая ветвь изотермы на диаграмме растворимости отвечает растворимости гидрата пятиокиси ниобия во фтористоводородной кислоте. Из очень концентрированных ( по HF) растворов выделяется NbF5, причем растворимость пентафторида ниобия осложняется явлением пересыщения растворов. [24]
Хульмом ( патент США 4 065405, 27 декабря 1977 г.; фирма Экссон Рисерч энд Инженеринг Компания), предназначен для извлечения пентафторидов тантала и ( или) ниобия из дезактивированного или частично дезактивированного катализатора переработки углеводородов. В состав данного катализатора входят: а) пентафторид металла, выбранный из группы, включающей пентафторид тантала, пентафторид ниобия и их смеси, и б) фтористый водород. Для извлечения металлов катализатор дистиллируют в присутствии кислоты Льюиса, не содержащей упомянутых металлов V группы. При этом происходит вытеснение пентагалогенидов тантала и ( или) ниобия в газовую фазу. При последующем добавлении фтористого водорода пентагалогениды превращаются в пентафто-риды. [25]
Влага действует на них очень легко, в результате чего сначала образуются оксифториды и оксифторокомплексы, а в конечном итоге - пятиокиси. Их реакции с различными элементами, кислотами, основаниями, хлоридами неметаллов и различными органическими соединениями приводят к выводу, что пентафторид ниобия несколько более реакционноспо-собен. [26]
Плотности их паров отвечают простым молекулам ЭГз. Они имеют структуру триго-нальной бипирамиды с атомом Э в центре [ d ( NbCl) 2 29 A, d ( TaCl) 2 30 А, c ( ( NbBr) 2 46 A, d ( TaBr) 2 45 А ], Пентафториды ниобия и тантала склонны к переохлаждению. С) при нагревании разлагается еще до достижения точки кипения. Рассматриваемые пентагалогеииды довольно хорошо растворимы в эфире и способны образовывать с ним кристаллоэфираты ЭГв ( CzHsbO. Желтоватый хлорофторид ЫЬСЦР способен, по-видимому, существовать и в ионной, и в молекулярной форме ( ср. [27]
При этом она получается равной - 341 4 ккал / моль. Теплота образования кристаллических пентафторидов ниобия и тантала определена прямым методом 141 42 ]: ЛЯ / 298 ( NbF5, кр. В работе Амосова [43], посвященной обзору термохимических свойств галидов ниобия и тантала, теплота образования пентафторидов ниобия и тантала оценена сравнительным: методом. Полученные им значения весьма далеки от экспериментальных величин. [28]
Это соединение относится к первой из указанных выше групп. Но наиболее удобным методом получения является транспортная реакция между металлическим ниобием и пентафторидом ниобия. Ниобиевую фольгу помещают в один конец толстостенной никелевой трубки в атмосфере аргона, а в противоположный ее конец - избыток пентафторида ниобия. [29]
Такое допущение правомерно, поскольку NbF5 и TaFa являются однотипными соединениями с одинаковой кристаллической решеткой. Погрешность такого допущения не превышает - 1 ккал / молъ. Она равна - 410 5 2 и 432 2 ккал / молъ соответственно для пентафторида ниобия и тантала. [30]
Страницы: 1 2