Пентахлорид - ниобий
Cтраница 3
В работе [64] показано, что с помощью ректификации можно получить пентахлорид ниобия высокой чистоты с содержанием Ы0 - 6 % Та и 1 - 10 - 4 % Al, Si, Fe. [31]
На первой стадии производят отделение практически всех сопутствующих примесей от суммы пентахлоридов ниобия и тантала в колоннах малой эффективности с барботажными тарелками. Учитывая возможность отложения на тарелках хлорокиси ниобия, присутствующей в исходном техническом хлориде, следует применять тарелки провального типа. На второй стадии ректификации происходит очистка пентахлорида ниобия от пентахлорида тантала. [32]
Пентафторид ниобия NbFs получается прямым действием сухого фтора на нагретый до 300 ниобий или взаимодействием между пентахлоридом ниобия и безводным фтористым водородом. Возогнанный в вакууме пента-фторид получается в виде бесцветных моноклинических призм. Если внести NbFs в среду фтористоводородной кислоты высокой концентрации, то образуется фторониобиевая кислота FbNbF. Получены многие соли обеих названных кислот. [33]
Известны соединения NbCl ( OCeH3) 4, NbCl2 ( OC10H7) 3, образующиеся при обработке пентахлорида ниобия раствором фенола или - нафтола в сероуглероде. [34]
Триметилдихлорниобий ( СН3) 3МЬС12 и триметилдихлортантал ( СН3) 3ТаС12 были получены обменной реакцией между диметилцинком и пентахлоридами ниобия и тантала при низкой температуре. Эти экзотермические реакции осуществляли, медленно добавляя диметилцинк к пентахлоридам при - 78 С в глубоком вакууме. Триметилдихлорниобий образуется в виде золотисто-желтых кристаллов, которые легко возгоняются в вакууме при комнатной температуре. Он устойчив при - 78 С, но медленно разлагается при комнатной температуре. [35]
На кривых охлаждения имеются остановки, соответствующие кристаллизации из расплава твердых растворов хлористого алюминия и хлорного железа ( или твердого раствора пентахлоридов ниобия и тантала), и остановки, соответствующие затвердеванию тройной эвтектики. Температура плавления эвтектики не отличается заметно от температуры плавления чистого четыреххлористого титана. Растворимость хлорного железа в четыреххлористом титане заметно повышается в присутствии хлористого алюминия: растворимость их смеси является средней величиной между растворимостью чистых хлоридов железа и алюминия и зависит от соотношения между содержанием этих хлоридов в растворе. [36]
Проводя фракционированную перегонку смеси пентахлоридов ниобия и тантала, я установил, что точка кипения пентахло-рида тантала равна 232 2, а пентахлорида ниобия - 246 1 при 740 мм рт. ст. Эти значения хорошо согласуются со значениями соответственно 232 9 и 247 4 ( 760 мм рт. ст.), приведенными в Journal of the Chemical Society за 1957 г., и новыми данными, опубликованными фирмой Union Carbide. [37]
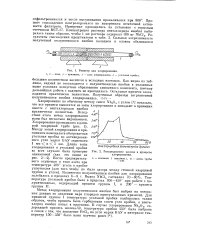 |
Реактор для хлорирования. 1 2 - печи, з - приемник, 4 - зона хлорирования, 5 - угольная пробка.| Распределение железа в процессе хлорирования. [38] |
Хлорирование по обычному методу смеси Nb205 с углем [4] показало, что все примеси выносятся из зоны хлорирования и попадают в приемник вместе с пентахлоридом ниобия практически полностью. Вследствие этого метод хлорирования нами был несколько видоизменен. [39]
Герцог и Шустер [31 ] получили продукт, содержащий ниобий нулевой валентности с координационным числом шесть, - трис-2 2 -дипиридилниобий ( 0), - восстанавливая пентахлорид ниобия дилитиидипиридилом в холодном растворе дипиридила в тетрагидро-фуране. В ходе реакции раствор окрашивался в ярко-синий цвет и из него выпадали фиолетовые кристаллы, на воздухе моментально разлагавшиеся с выделением тепла. Соединение парамагнитно ( я фф 1 75 0 07УИВ), что указывает на присутствие неспаренных электронов и соответствует 4d25s5p3 - кoнфигypaции трех дипиридильных молекул. [40]
В данной работе была сделана попытка проследить за поведением некоторых примесей, встречающихся в полупятиокиси ниобия в процессе ее хлорирования, и провести предварительную очистку пентахлорида ниобия непосредственно в процессе хлорирования. [41]
Соединения NaNbCl6 и NaTaCl6 гораздо менее устойчивы, чем соединения NaAlCl4 и NaFeCl4, и имеют значительно более высокие температуры плавления, поэтому очистку четыреххлористого титана от пентахлоридов ниобия и тантала следует проводить при более высокой температуре. [42]
Представляет существенный интерес возможность дальнейшего повышения выхода продукта особой чистоты путем использования загрязненного маточного раствора, в котором примеси концентрируются в 4 - 5 раз по сравнению с их содержанием в исходном пентахлориде ниобия. [43]
Кристаллизация расплава этого состава заканчивается в тройной эвтектической точке Е, и затвердевшая система состоит из фаз FeCl3, NaFeCl4 и NbCl5 - Давление паров NbCl5 и FeCls над системой пропорционально молярному содержанию пентахлорида ниобия и хлорида железа в расплаве. Смесь 6 выражается на диаграмме состояния точкой, лежащей в поле первичной кристаллизации NbCl5 - Кристаллизация расплава этого состава заканчивается в тройной эвтектической точке Ег, и затвердевшая система состоит из фаз, рассмотренных выше. Давление паров NbCl5 и FeCl3 над системой пропорционально содержанию компонентов в расплаве. Давление паров NbCl6 над системой в этом случае близко к давлению паров индивидуального пентахлорида. [44]
С металлическим ниобием, содержащим примеси в тех же количествах, что и технический фторониобат калия, было поставлено небольшое количество предварительных опытов, а основная работа была проведена со значительно более чистым пентахлоридом ниобия - заводским продуктом первичной ректификации технического пентахлорида ниобия. [45]
Страницы: 1 2 3 4