Большинство - двухатомная молекула
Cтраница 2
Этот результат был бы правильным, если бы основным состоянием молекулы О2 являлось сингулетное, как для большинства двухатомных молекул. Так как разница в энергиях трех уровней мала, то соответствующие им члены суммы состояний можно считать одинаковыми. [16]
Следовательно, наибольшее число молекул находится на нулевом колебательном уровне. Для большинства двухатомных молекул величины колебательных квантов таковы, что уже на первом уровне число молекул пренебрежимо мало по сравнению с нулевым уровнем. [17]
На рис. 2 изображена типичная кривая следующего электронного состояния, аналогичного первому возбужденному уровню изолированного атома. С химической точки зрения для большинства двухатомных молекул возбужденные состояния интересны лишь при очень высоких температурах или же в случае, когда на молекулы действует свет, энергия которого достаточна для того, чтобы вызвать переход из основного состояния в возбужденное. [18]
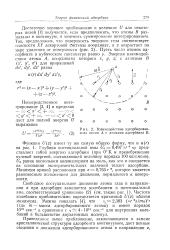 |
Взаимодействие адсорбированного атома А с атомами адсорбента В. [19] |
Частота колебания приблизительно определяется кривизной U ( г) вблизи минимума. Можно показать [4], что чг - 2 383 ( ег р / тп) 1 / ( где т - масса адсорбированного атома) и имеет порядок 1012 секг1 в сравнении с v - 4 101 3 секг1 для внутренних колебаний в большинстве двухатомных молекул. [20]
 |
Схема энергетических уровней двухатомных молекул типа Аг. [21] |
Сначала заполняются нижние уровни, причем на каждом уровне размещается не более двух электронов. Это следствие из принципа Паули объясняет эмпирическое правило Льюиса, установившего ранее ( 1916 г.) роль электродных пар в образовании ковалентных связей. Большинство двухатомных молекул Н2, Li2, N2, F2 диамагнитно, так как занятие молекулярных уровней парами электронов приводит к компенсации спиновых и орбитальных моментов. Интересным исключением является парамагнитная молекула О2, обладающая собственным моментом, равным двум магнетонам Бора. На рис. 1.9 показано распределение 16 электронов молекулы кислорода, заполняющих все низшие молекулярные уровни вплоть до уровня л 2, на который приходятся два электрона. [22]
Страницы: 1 2