Большинство - многоатомная молекула
Cтраница 1
 |
Конфигурации цепи с фиксированными валентными углами ( угол а. В молекуле имеются волчки на волчках. [1] |
Большинство многоатомных молекул, однако, не являются квазитвердыми: не одной, а нескольким конфигурациям молекулы отвечают минимумы потенциальной энергии, и между этими различными положениями равновесия возможны переходы. В таком случае наблюдаются внутренние движения, характеризующиеся большими смещениями ядер: внутренние вращения, внутренние перегруппировки. Так, в молекуле этана наблюдается внутреннее вращение групп - СН3 относительно друг друга, которое накладывается на вращение молекулы как целого. [2]
 |
Конфигурации цепи с фиксированными валентными углами ( угол а. В молекуле имеются волчки па волчках. [3] |
Большинство многоатомных молекул, однако, не являются квазитвердыми; не одной, а нескольким конфигурациям молекулы отвечают минимумы потенциальной энергии, и между этими различными положениями равновесия возможны переходы. [4]
Для большинства известных многоатомных молекул приведенный метод расчета не может быть применен из за неясности ряда величин, учитывающих влияние колебаний на уровни вращения. В этом случае приходится ограничиваться применением приближенных уравнений ( 65), ( 66), ( 67), ( 68), ( 69) для молекул формы палочки и ( 70), ( 71), ( 72), ( 73) и ( 74) для молекул, атомы которых не располагаются вдоль прямой линии. Таким образом и были рассчитаны термодинамические величины для большинства углеводородов. [5]
Для большинства простых многоатомных молекул сведения об их возбужденных электронных состояниях отсутствуют или носят разрозненный характер. Колебательные и вращательные постоянные молекул в возбужденных состояниях обычно неизвестны ( за исключением нескольких простых молекул типаНСМ, С2Н2, НСО и ОСЬ), а энергии этих состояний имеют величины порядка 15000 - 20000 см 1 и выше. Учитывая, что точность вычисления термодинамических функций многоатомных газов, как правило, ниже, чем двух атомных газов, для учета возбужденных состояний многоатомных молекул при всех температурах может быть применен метод, основанный на предположении, что колебательные и вращательные постоянные молекулы во всех электронных состояниях идентичны. [6]
Поскольку для большинства многоатомных молекул т очень мало ( сравнимо со временем свободного пробега молекулы или больше его лишь на один порядок), на первый взгляд может показаться, что граница в случае мономолекулярного распада расположена очень высоко, за пределами температурной области, представляющей практический интерес в химической кинетике. [7]
Тот факт, что в большинстве многоатомных молекул связи эффективно локализованы, дает возможность объяснить неизменность длины связи между двумя заданными атомами в различных молекулах. Разумеется, иногда наблюдаются небольшие, но весьма интересные различия в длине определенной связи А - В в зависимости от природы окружения. [8]
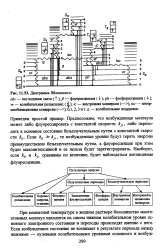 |
Диаграмма Яблонского. [9] |
При комнатной температуре в жидком растворе большинство многоатомных молекул находится на самом нижнем колебательном уровне основного электронного состояния и переходы происходят именно с него. [10]
С другой стороны, когда мы рассматриваем большинство многоатомных молекул, то оказывается очень трудно различить поделенные и неподеленные электроны и установить, какие из них промотированы и какие нет. Кроме того, в органической химии и в химии кодшлексных ионов, которые будут рассмотрены дальше, имеются серьезные доказательства того, что существуют локализованные валентные связи с определенными направлениями. Во всех тех случаях когда существуют такие локализованные валентные связи, кажется более удобным, по крайней мере для наших целей, изображать их с помощью электронных пар, хотя Мулликен и разобрал недавно многоатомные молекулы несколько подробнее. [11]
Для большинства многоатомных молекул в основном электронном состоянии орбитальный момент количества движения электронов равен нулю. Для молекул ( или молекулярных ионов) в жидкой фазе вращательное состояние не описывается волновыми функциями ротатора и не характеризуется моментом количества движения, обусловленным свободным вращением молекулы как целого. [12]
Модель молекулы строится на основе известных величин длин и-углов связи. Для большинства многоатомных молекул возможно несколько молекулярных моделей с мало отличающимися величинами момента инерции. Любая модель, построенная на основе принятых длин связи и углов, будет пригодна для целей вычисления энтропии. [13]
В отношении изменения мультиплетности при поглощении света многоатомными молекулами, составленными из легких атомов, справедливы те же правила, что и для атомов и двухатомных молекул. Поскольку большинство многоатомных молекул в основном состоянии синглетно, кроме редких исключений, при поглощении света образуется возбужденное синглетное состояние. В присутствии парамагнитных частиц ( а также, вероятно, в достаточно сильных магнитных полях) можно наблюдать синглет-триплетные переходы. Поэтому в бензоле, имеющем синглет-синглетный переход, который начинается около 2680 А, поглощение при наличии больших количеств кислорода [128] простирается вплоть до 3400 А. [14]
В аналогичных таблицах для многоатомных молекул даны значения соответствующих постоянных, когда они известны ( кроме структурных параметров, которые приводятся не в таблицах, а в тексте), а также числа симметрии молекул и степень вырождения частот колебаний. Поскольку для большинства многоатомных молекул значения частот нормальных колебаний и вращательных постоянных неизвестны, в таблицах, как правило, даны значения основных частот vn и произведений главных моментов инерции / л в / с ( см. стр. [15]
Страницы: 1 2