Большинство - реакция - электрофильное замещение
Cтраница 1
Большинство реакций электрофильного замещения в ряду метал-лоорганических соединений протекает по механизму S. [1]
Большинство реакций электрофильного замещения в ряду метал-лоорганических соединений протекает по механизму S. SEi), при котором наиболее важной стадией является атака электрофила по атому углерода, связанному с металлом. [2]
В отличие от большинства реакций электрофильного замещения реакция нитрозирования не позволяет вводить несколько нитрозогрупп в одно и то же кольцо. Исключение составляют соединения, имеющие более чем одну гидрокси - или аминогруппу. В тех случаях, когда в молекуле имеются два или более бензольных кольца, активированных как минимум одной гидрокси - или аминогруппой, удается ввести нитрозогруппу в каждое из них. Бензольные ядра при этом могут быть как конденсированными, так и неконденсированными. [3]
Соответственно этому уравнению, скоростьлимитирующей стадией большинства реакций электрофильного замещения является стадия образования о-комплекса. Поскольку стадия 4 - реароматизация - описывается тем же кинетическим уравнением ( 1), решение вопроса о скоростьлимитирующей стадии требует дополнительных данных, в частности, изучения кинетического изотопного эффекта ( КИЭ) реакции. [4]
С помощью кинетических методов показано, что большинство реакций электрофильного замещения в ароматическом ряду протекает по двухстадийному механизму. [5]
В соответствии с этим уравнением можно было бы ожидать, что ско-ростьлимитирующей стадией большинства реакций электрофильного замещения является стадия образования а-комплекса. Однако, поскольку стадия 4 - реароматизация - описывается тем же кинетическим уравнением, решение вопроса о скоростьлимитирующей стадии требует дополнительных данных. Такие данные получают, в частности, при изучении кинетического изотопного эффекта реакции. [6]
Однако кинетический метод с использованием ароматических соединений, меченных дейтерием и тритием, позволил однозначно установить, что большинство реакций электрофильного замещения в ароматическом ядре притекает по двухстадийному механизму. [7]
Однако кинетический метод с использованием ароматических соединений, меченных дейтерием и тритием, позволил однозначно установить, что большинство реакций электрофильного замещения в ароматическом ядре протекает по двухстадийному механизму. [8]
Нафталин обладает большей по сравнению с бензолом реакционной спосс бностью. Большинство реакций электрофильного замещения свойственны нафталину и могут протекать в зависимости от условий в а-или Р - положение. [9]
Согласно значениям констант скорости замещения ( стр. Так как большинство реакций электрофильного замещения проходит в кислой среде, NH2 - группа превращается в соль и ее влияние соответственно ослабляется. Интересным примером является трифенилметилирование оаминофенола. [10]
Образование больших количеств мета-изомера вопреки правилам ориентации в настоящее время объясняется следующим образом. В отличие от большинства реакций электрофильного замещения лкшттфпвянт - реакция обратимая. [11]
Для соединений ароматического характера, имеющих замкнутую л-электронную систему, наиболее характерны реакции с электрофиль-ными агентами. С помощью кинетических методов показано, что большинство реакций электрофильного замещения в ароматическом ряду протекает по двухстадииному механизму. [12]
В тех случаях, когда kn / ko или kn / kp равно 1, говорят, что кинетический изотопный эффект отсутствует. В этих реакциях стадия 3 является скоростьлимитирующей. Большинство реакций электрофильного замещения в ароматическом ряду не обнаруживают кинетического изотопного эффекта. [13]
Например, бромирование пиридина элементарным бромом требует высоких температур ( 200 - 300) и идет с образованием р-изомера. Пассивность пиридина в реакциях электрофильного замещения обусловлена еще двумя факторами. Во-первых, большинство реакций электрофильного замещения протекает в сильно кислой среде, а у атома азота имеется неподеленная пара электронов, не входящая в ароматическую систему. Поэтому в условиях проведения большинства реакций электрофильного замещения сначала происходит протонирование атома азота с образованием солей пиридина, что приводит к еще большему снижению электронной плотности в ароматическом кольце. [14]
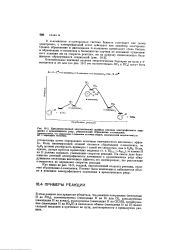 |
Идеализированный энергетический профиль реакции электрофильного замещения в ароматическом ряду, учитывающий образование л-комплекса. [15] |
Страницы: 1 2