Большинство - реакция - окисление
Cтраница 2
 |
Схема процесса окисления металла. [16] |
Для большинства реакций окисления характерен первый случай, что объясняется заметно меньшей величиной радиусов ионов металла по сравнению с радиусом иона кислорода. [17]
 |
Схема процесса окисления металла. [18] |
Для большинства реакций окисления характерен первый случай, что объясняется заметно меньшей величиной радиусов ионов металла по сравнению с радиусом иона кислорода. Особенно сильно на газовую коррозию влияет состав газовой фазы. [19]
В большинстве реакций окисления в качестве главных активных промежуточных продуктов образуются гидроперекиси. Цепь с участием перекисного я углеводородного радикалов была разработана А. Р. Уббелоде [7], который считает, что протекающая в объеме главная химическая реакция окисления насыщенного углеводорода начинается с образования гидроперекиси, распадающейся затем на альдегид и воду. [20]
В большинстве реакций окисления, проводимых по способу Байера - Виллигера с использованием щелочной перекиси водорода, применяют разбавленный едкий натр, который берут в небольшом избытке против количества, необходимого, чтобы поддерживать в растворе реагенты и продукты реакции. [21]
В большинстве реакций окисления с участием кислорода выделяются тепло и свет - такие процессы называются горением. [22]
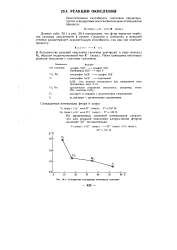 |
Стандартные электродные потенциалы галогенов. [23] |
В большинстве реакций окисления галогены реагируют в виде молекул Х2, образуя гидратированный ион Х - ( води. [24]
Так как большинство реакций окисления бихроматом калия являются сильно экзотермичными, то термометрический метод имеет вообще большую перспективу применения. [25]
Характерной особенностью почвенных условий является необратимость большинства реакций окисления и восстановления, протекающих в почве. С другой стороны, в почве протекает большое число окислительно-восстановительных реакций биохимической природы. [26]
Не приводя здесь схем окисления других углеводородов, можно сказать, что большинство реакций окисления горючих веществ вдет не прямым путем, а через промежуточные стадии, развиваясь целиком или на отдельных этапах по цепному механизму. Промежуточными продуктами цепных реакций окисления являются не целые молекулы, а их осколки - свободные радикалы и атомы. [27]
Надо сказать, что английский химик Риче [241] в середине-30 - х годов вообще большинство реакций окисления интерпретировал первоначальным внедрением кислорода между С и Н атомами, непосредственно примыкающими к активирующей СО-или С С-группе. [28]
Металлы используют и в некоторых реакциях окисления ( напомним катализируемое платиной превращение SU2 в ЗОз), но большинство реакций окисления катализируется окислами металлов. [29]
Металлы используют и в некоторых реакциях окисления ( напомним катализируемое платиной превращение ЗСЬ в SO3), но большинство реакций окисления катализируется окислами металлов. [30]
Страницы: 1 2 3