Большинство - простое вещество
Cтраница 2
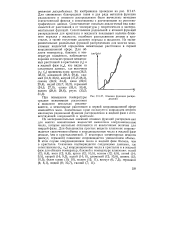 |
Атомная функция распределения. [16] |
Из экспериментальных значений атомных функций распределения для многих моноатомных жидкостей вычислены координационные числа, которые несколько отличаются от аналогичных величин для твердой фазы. Для большинства простых веществ плавление сопровождается увеличением объема и координационные числа в жидкой фазе меньше, чем в кристаллической. У некоторых элементарных веществ ( висмут, германий) плавление сопровождается уменьшением объема. [17]
Кислород при нагревании и в присутствии катализатора проявляет высокую-химическую активность. С большинством простых веществ он взаимодействует непосредственно, образуя оксиды; лишь по отношению к фтору проявляет восстановительные свойства. [18]
Кислород обладает высокой химической активностью, особенно при нагревании и в присутствии катализатора. С большинством простых веществ он взаимодействует непосредственно, образуя оксиды. Лишь по отношению к фтору кислород проявляет восстановительные свойства. [19]
С большинством простых веществ он взаимодействует непосредственно, образуя оксиды. Атомный кислород значительно активнее молекулярного. [20]
По химической активности кислород уступает только фтору. С большинством простых веществ он реагирует непосредственно, за исключением галогенов, благородных газов, платины и золота. [21]
По химической активности кислород уступает только фтору. С большинством простых веществ он реагирует непосредственно, за исключением галогенов, благородных газов, платины и золота. Два неспаренных электрона в невозбужденном состоянии атома кислорода определяют его двухвалентность. Атом кислорода может находиться в sp -, sp2 - и р3 - гибридном состоянии. Например, в оксидах со структурным типом NaCl каждый атом кислорода соединен тремя трехцентровыми связями с шестью соседними атомами металла ( к. А в оксидах типа Na2O координационное число достигает 8, и он образует четыре трехцентровые связи с 8 атомами металла. [22]
По химической активности кислород уступает только фтору. С большинством простых веществ он реагирует непосредственно, за исключением галогенов, благородных газов, платины и золота. Два неспаренных электрона в невозбужденном состоянии атома кислорода определяют его двухвалентность. Атом кислорода может находиться в ар -, sp2 - и 5р3нгибридном состоянии. Например, в оксидах со структурным типом NaCl каждый том кислорода соединен тремя трехцентровыми связями с шестью соседними атомами металла ( к. А в оксидах типа NajO координационное число достигает 8, и он образует четыре трехцентровые связи с 8 атомами металла. [23]
Фтор - газ, слабоокрашенный в толстых слоях в зеленовато-желтый цвет, с резким запахом, очень ядовит. С большинством простых веществ реагирует уже при обычных условиях. [24]
Если вещество в стандартных условиях является жидким или твердым, то А / / / ( Газ) находят, прибавляя к ДЯ энтальпию испарения или сублимации этого вещества. Энтальпии атомизации большинства простых веществ достаточно точно установлены и являются справочными величинами. [25]
Теплота образования химического соединения из простых веществ не определяет еще энергии связи между атомами в молекуле данного соединения. Так как молекулы большинства простых веществ состоят из нескольких атомов, то образование сложного вещества не является простой реакцией соединения атомов одного элемента с атомами другого, а реакцией, в которой молекулы простых веществ обмениваются атомами. [26]
Большинство простых веществ относится к металлам. [27]
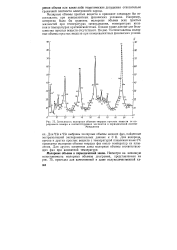 |
Зависимость молярных объемов твердых простых веществ от порядкового номера п соответствующих элементов в периодической системе. [28] |
Например, интересно было бы сравнить молярные объемы всех простых жидкостей при температурах затвердевания, температурах кипения и температурах критической точки. Однако такие данные для большинства простых веществ отсутствуют. [29]
 |
Характеристики некоторых веществ. [30] |
Страницы: 1 2 3