Большинство - спирт
Cтраница 1
Большинство спиртов также дегидратируется при сравнительно высоких температурах в присутствии твердых катализаторов, таких, как силика-гель или окись алюминия; при этом образуются алкены и ( или) простые эфиры. [1]
Большинство спиртов также дегидратируется при сравнительно высоких температурах в присутствии твердых катализаторов, таких, как силикагель или окись алюминия; при этом образуются алкены и ( или) простые эфиры. Превращения этанола, суммированные в приведенных ниже уравнениях, характерны для первичных спиртов. [2]
Большинство спиртов также дегидратируется при сравнительно высоких температурах в присутствии твердых катализаторов, таких, как силика-гель или окись алюминия; при этом образуются алкены и ( или) простые эфиры. [3]
Большинство спиртов и кетонов, мыла, моющие средства и растворители для сухой чистки не оказывают действия на терилен. [4]
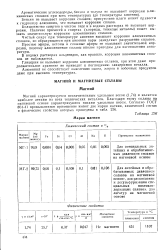 |
Марки магния. [5] |
Большинство спиртов в чистом виде и в водных растворах не вызывает коррозии. Наличие примесей в спиртах ( хлориды, тяжелые металлы) может вызвать значительную коррозию алюминиевых сплавов. [6]
Поседение большинства спиртов в реакции обмена согласуется с их поведением в реакции этерификации, в которой разрывается связь О - Н, а не связь С - О ( см. стр. [7]
Гидроксильные группы большинства спиртов при отсутствии в молекуле групп, уменьшающих их стабильность, весьма устойчивы по отношению к гидрогенолизу. Однако если в молекуле имеется ароматическая система в - положении к гидроксильной группе, то при гидрировании происходит разрыв по углерод-кислородной связи. [8]
Гидроксильные группы большинства спиртов в редких случаях отщепляются при каталитическом гидрировании, и спирты часто используют как растворители для гидрирования других соединений. Среди других реагентов, применявшихся для этой цели - дииододиметилсилан Me2SiI2 [905], Fe ( CO) 5 [906], P2I4 [907] и оловов соляной кислоте. Гликоли вступают в реакцию гидрогенолиза особенно легко. [9]
Как будет показано ниже, большинство спиртов дает в низкочастотной области две полосы, которые чувствительны к изменениям водородных связей и которые при разбавлении раствора сдвигаются в сторону более низких частот. Однако, к сожалению, имеется много противоречивых данных по вопросу о том, к каким колебаниям следует отнести каждую из этих полос, и, действительно, обе могут быть в одинаковой степени связаны с деформационными колебаниями ОН, а не с валентными колебаниями СО. [10]
Из этих исследований ясно, что большинство спиртов дают две полосы, которые независимо от их происхождения достаточно характерны для того, чтобы по ним можно было судить о структуре, если бы при этом имелось достаточно данных, связывающих частоты с различными структурными изменениями. Однако в настоящее время число таких данных ограничено; по этой причине, а также из-за изменений спектров между 1450 и 600 см - х в зависимости от состояния вещества эта область имеет ограниченное применение для структурного анализа. [11]
Концентрированные бромистоводородная и иодистоводородная кислоты легко реагируют с большинством спиртов. [12]
Слабо растворим в воде ( 20 - 25 частей на 1 млн.) и в нефтяных маслах: смешивается с большинством спиртов, эфнрон. Ограниченно растворим в фосфорной кислоте ( ср. [13]
С при 0 7 мм рт. ст. Растворимость в воде при 25 С - приблизительно 145 мг / кг, хорошо растворяется в большинстве спиртов, эфирах, кетонах и ароматических растворителях. [14]
Для оксимов характерна чрезвычайно интенсивная основная полоса поглощения гидроксильной группы при 2 78 мкм, причем соответствующие молярные коэффициенты погашения в 3 - 4 раза превышают молярные коэффициенты погашения большинства спиртов и гидроперекисей и примерно равны коэффициентам погашения фенолов. [15]
Страницы: 1 2 3