Большинство - гидрид
Cтраница 1
Большинство гидридов термически неустойчивы, некоторые из них самовоспламеняются на воздухе. [1]
Большинство гидридов термически неустойчиво и при повышении температуры разлагается. Вначале образуются более бедные водородом соединения и водород, а при полном разложении - элементы. [2]
 |
Легкость восстановления различных функциональных групп алюмогидридом лития в эфире.| Легкость восстановления различных функциональных групп бораном. [3] |
Большинство гидридов металлов представляет собой нук-леофильные агенты и атакуют атом углерода при действии на кратную или одинарную связь углерод - гетероатом. Однако ВН3 [424] и А1Н3 [425] представляют собой электрофилы ( кислоты Льюиса) и поэтому атакуют гетероатом. [4]
 |
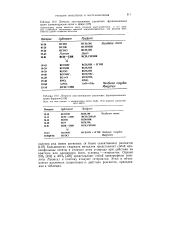
Зависимость давления вы - 20 целяемого из MgH2 водорода от температуры. 10. [5] |
Вообще для большинства гидридов металлов характерны высокие температуры и небольшие давления водорода. [6]
Для синтеза большинства гидридов применяется молекулярный водород, получаемый указанными методами. Однако для некоторых относительно инертных металлов применяется активный водород в атомарном виде, где при реакции гидрирования не требуется затрат энергии на диссоциацию очень прочной молекулы водорода. Некоторые гидриды, такие как гидриды золота и серебра, получают только действием атомарного водорода. [7]
В инфракрасных спектрах большинства гидридов наблюдаются полосы в области 1700 - 2300 см -, которые могут быть отнесены к валентным колебаниям металл-водород. Отнесение только на основе положения полосы может привести к ошибкам, поскольку другие колебания, например колебания, связанные с карбонильными и цианидными группами и с координированным азотом, также проявляются в этой области. Поэтому, если возможно, желательно изучить дейтерозамещенные аналоги. В приближении двухатомного гармонического осциллятора частота для колебания М - D должна быть ниже частоты колебания М - Н в 1 4 раза; наблюдаемые сдвиги приблизительно согласуются с этим предположением. Дополнительное осложнение возникает из-за переменной интенсивности полосы VMH. В некоторых хорошо охарактеризованных гидридах, например в СоН [ Р ( ОС6Н5) alt, эта полоса настолько сллба, что не наблюдается. [8]
Отсутствие стехиометрических отношений для большинства гидридов переходных металлов часто давало повод все их относить к сплавоподобным веществам. Например, Хэгг [652] еще в 1929 г. выдвинул положение, что все переходные металлы образуют с металлоидами второго периода периодической системы, имеющими малые атомные радиусы ( 1 А), только вещества типа металлических сплавов. Даже для соединений, образуемых одним каким-либо металлом, например натрием или магнием, как это показал Цинтль [653], характер химической связи зависит от положения металла - партнера в периодической системе. [9]
При погружении в воду большинства гидридов металлов, перечисленных на рис. 12.1, происходит энергичное выделение водорода. В воде остается очень небольшая часть газообразного водорода. Плохая растворимость водорода в воде согласуется с тем, что свойства этого газа близки к идеальным и, следовательно, между его молекулами, а также молекулами водорода и других веществ, должны возникать очень небольшие силы взаимодействия. [10]
В случае алюмогидрида лития и большинства других гидридов металлов механизм представляет собой простое нуклео-фильное замещение, где атака осуществляется гидрид-ионом, который может быть или не быть свободным. Скорее всего реализуется механизм S 2, а не SN. [11]
В настоящее время мы знаем, что большинство гидридов, оксидов, халькогенидов, нитридов, карбидов, силицидов и других соединений также являются соединениями переменного состава. Это означает, что данная фаза, обладая структурой типа NaCl, имеет область гомогенности ( не распадается на другие фазы) в широком интервале составов от Ti00 70 до TiOt. Карбид титана TiC имеет в действительности состав от TiC060 до TiC. [12]
В настоящее время мы знаем, что большинство гидридов, оксидов, халькогенидов, нитридов, карбидов, силицидов и других соединений также являются соединениями переменного состава. Карбид титана TiC имеет в действительности состав от TiC0i60 до TiC. В случае, например, карбида TiC0i72 можно в первом приближении принять, что подрешетка титана целиком заполнена, в подрешетке же углерода, при данном составе, вместо 28 % атомов С находятся вакансии с. [13]
В этом разделе рассмотрены только такие методы, которые можно использовать для всех или большинства гидридов. Основной метод анализа гидридов заключается в разложении гидролизом с выделением водорода и в последующем титровании образующегося при гидролизе раствора. [14]
Хотя связь металл-углерод может образоваться в результате ряда реакций с использованием гидридов металлов в качестве исходных продуктов, однако высокая стоимость и трудность получения большинства гидридов делает эти синтезы значительно менее привлекательными, чем более общепринятые методы. Исключение может представлять общая реакция присоединения соединений со связью металл - водород к двойной или тройной углерод-углеродной связи с образованием новой связи углерод-металл. Эта реакция является довольно общей и легко протекает с рядом гидридов, включая гидриды алюминия, бора и кремния. Еще много нужно сделать для того, чтобы установить, насколько общей является эта реакция, но есть основание полагать, что многие гидриды I-VII групп будут реагировать с олефинами, образуя связь углерод - металл. [15]
Страницы: 1 2