3-оксипиридин
Cтраница 3
Продолжая исследования по синтезу новых серосодержащих соединений из сероокиси углерода ( COS), спиртов, целлозольвов и фенолов, мы перешли к изучению гидроксилсодержащих гетероаромати-ческих соединений. В качестве представителя последних был выбран 3-оксипиридин. [31]
Конопницкий и Плацек87 получили 2 3-диаминопиридин из Юг 3-аминопири-дина ( полученного из р-аминопиколиновой кислоты при 350), 12 г N № N3 и 30 ел3 р-цимола при нагревании до 210 с обратным холодильником. Диамино-пнридин м получается при нагревании 5 г 3-оксипиридина с б г МНгКа и 15 си3 р-цимола. [32]
Легко нитруются аминопроизводные; так 2 -, 3 - и 4-аминопиридины ( например, при действии H2S04 - HN03, 40) образуют моно - ( 5 -, 2 - и 3-соответ-ственно) и динитропроизводные ( 3, 5 -, 2, 6 - и 3, 5-соответственно) ( ср. Аналогично соответствующим аминопроизводным реагируют алкиламино -, алкокси - и 3-оксипиридины. [33]
Обычно в эти реакции вступают пиридины, содержащие гидроксильную или аминогруппу; например, 3-оксипиридин и формальдегид дают 2-оксиметил - З - оксипиридин; 2 6-диаминопиридин образует соответствующие 3-нитрозо - ( при действии NaNO2 - H2O, Н) и 3-фенилазопроизводные ( 26, стр. [34]
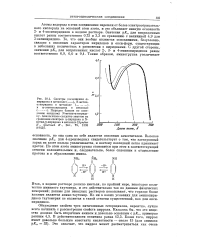 |
Спектры поглощения а. [35] |
Атомы водорода в этих соединениях перешли от более электроотрицательного кислорода на основной атом азота, и это объясняет низкую основность 2 - и 4-оксипиридинов в водном растворе. Значения рКа для сопряженных кислот равны соответственно 0 75 и 3 3 по сравнению с величиной 4 9 для 3-оксипиридина. То, что они вообще являются основаниями, безусловно, связано с основным характером пиридонов и окси-форм, существующих в небольших количествах в равновесии с пиридонами. [36]
Структура последнего соединения была установлена путем окисления его в 3-оксипиколиновую кислоту. Реакция 3-оксипиридина с формальдегидом наглядно показывает пониженную активность пиридинового ядра сравнительно с активностью ядра фенола: в то время как реакция фенола с формальдегидом с большим трудом поддается регулированию и ведет к образованию полимеров, реакция 3-оксипиридина регулируется легко. [37]
Подобное различие в поведении в зависимости от занимаемого положения наблюдается и в случае других заместителей. Так, атомы водорода алкильных групп, расположенных в а - или у-положении, обладают особой реакционной способностью, которую они не проявляют в - положении; карбоксилы в положениях а или у декарбоксгогаруются значительно легче, чем в 3-положении, а а - и у-оксипиридины в отличие от ( 3-оксипиридинов взаимодействуют также в таутомерных кетонных формах. [38]
Страницы: 1 2 3