Бонгоффер
Cтраница 1
Бонгоффер, Фаркаш и Руммел [56], наблюдавшие это явление, предполагали, что разница в температурном коэффициенте не зависит от катализаторов. Как положительные, так и отрицательные температурные коэффициенты можно наблюдать в обеих группах катализаторов, они зависят от температуры и свойств поверхности. Вообще, положительные и отрицательные температурные коэффициенты могут быть найдены для одного и того же вещества. Положительный температурный коэффициент удается наблюдать выше комнатной температуры, а отрицательный - лишь при низких температурах. Эти результаты были объяснены; предполагалось, что существуют два различных механизма реакции: 1) при низкой температуре происходит конверсия изолированных водородных молекул в поле мономолекулярных превращений адсорбционного слоя и имеется отрицательный температурный коэффициент процесса и 2) при высокой температуре конверсия происходит в поле активированной адсорбции, она является результатом десорбции атомов и их рекомбинации с образованием новых молекул. [1]
Бем и Бонгоффер 1г8 в своих опытах с тлеющим разрядом получили примерно 60 % - ную перекись водорода, Гейб и Гар тек 1хд - даже выше 70 % - ной. [2]
Виртц и Бонгоффер [125] заметили, что молекулярный водород участвует в обменной реакции с раствором щелочи в тяжелой воде при длительном нагревании. Абе [126] ошибочно приписал обмен присутствию коллоидального железа. Это опроверг Вильмарт с сотрудниками [127], подробно изучивший кинетику обменной реакции. [3]
Виртц и Бонгоффер [120] няшли, что при проведении этой реакции в тяжелой воде выделяющийся водород оказывается легким независимо от того, в кислом, нейтральном или щелочном растворе проводится реакция. [4]
В соответствии с исследованиями Бонгоффера и сотрудников 92, сразу после репассивации, а также еще в течение некоторого времени ( минуты) минимальная плотность тока ia и минимальное количество электричества Q заметно повышены. [5]
Получение параводорода по методу Бонгоффера и Хартэка [34] описано также Клеменсом. [6]
В 1936 г. Вирц и Бонгоффер [2] показали, что при 100е С идет изотопный обмен водорода между молекулярным водородом и окисью дейтерия в ( присутствии щелочи. В отсутствие щелочи реакция не идет. [7]
В дальнейшем, однако, Бонгоффер показал [114, 88], что энолизация представляет собой реакцию, протекающую одновременно с обменом и независимо от него. Действительный механизм процесса может быть разделен на следующие стадии. [8]
Как показали Фаркаш и Мелвил [83], Бонгоффер, Гартек и Гэйб [84], молекулы других газов также легко диссоциируют при столкновении с возбужденными атомами ртути. [9]
Тщательное исследование автоколебаний в электрохимических системах проведено Бонгоффером ( Bonhoeffer et al, 1948), который использовал для качественного описания модифицированную модель автогенератора Ван дер Поля. Бонгоффер выразил сомнение; в практической осуществимости колебаний в гомогенных системах, указав, однако, что в принципе такие колебания возможны. [10]
Для этого случая большинство исследователей отдает предпочтение адсорбционно-десорб-ционному механизму Бонгоффера - Фаркаша. [11]
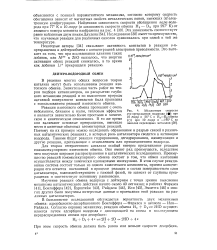 |
Абсолютные скорости о-я-превращения водорода ( при 10 торр и 26 С и Н3 - О2 - обмена ( О при 10 торр и - 196 С на окислах переходных металлов. [12] |
В большинстве исследований обсуждается вероятность двух механизмов обмена: адсорбционно-десорбционного Бонгоффера - Фаркаса и цепного - Или - Райдила. [13]
Возможность реализации рассмотренного механизма пассивации железа за счет кислородных соединений становится еще более вероятной, если принять механизм анодного растворения, предложенный Колотыркиным, Кабановым, Бонгоффером, Бокрисом, Лоренцем, Хойслером [5-10] и заключающийся в непосредственном участии компонентов агрессивной среды в элементарных актах анодного растворения металлов. [14]
Позднее Франк 26 методом потенциостатического снятия кривых плотность тока - напряжение ( рис. 346) установил хорошее соответствие между значениями Фладе-потенциала, полученными при пассивировании и при активировании, что вытекало уже из данных измерений Бонгоффера и Феттера 23 - 25 и использовалось при толковании механизма процесса. Потенциостатический метод еще раньше был применен Бартлеттом 27, который также исследовал пассивацию железа и получил аналогичные кривые. [15]
Страницы: 1 2