Переход - реагент
Cтраница 1
Переход реагента из газовой фазы к поверхности катализатора сквозь слой жидкости толщиной h можно показать на модели ( рис. 1); диффузионное сопротивление сосредоточено либо в пленке, окружающей частицу катализатора, либо в пленке на поверхности раздела газ - жидкость. [1]
В случае одноэлектронного переноса обычно происходит переход реагентов в свободнорадикальную или ион-радикальную форму. В результате этого в зависимости от значений констант скорости элементарных р-ций радикалов с реагентами и катализатором и их относит, концентраций может осуществляться радикальный или радикально-цепной механизм катализа. [2]
Активаторы - агенты, способные вызывать переход реагентов в активное состояние. [3]
АЯ, AS0 и AG представляют собой стандартные изменения термодинамических величин при переходе реагентов из основного состояния в состояние активированного комплекса. [4]
Весьма нестрО1 ое определение, под которым, как правилолюнимают такое химическое превращение, когда для перехода реагентов в продукты необходимо преодолеть только одно переходное состояние. Элементарная реакция можег быть моно -, би - и значительно реже тримолекулярнои. [5]
Весьма нестрогое определение, под которым, как правило понимают такое химическое превращение, когда для перехода реагентов в продукты необходимо преодолеть только одно переходное состояние. Элементарная реакция может быть моно -, би - и значительно реже т молекулярной. При этом порядок и молекулярность совпадают. Элементарная реакция характеризуется соответствующей элементарной константой скорости реакции. Отсюда следует: химическая реакция, которая включает две и более элементарные реакции, является многостадийной химической реакцией. В этом случае реагенты от продуктов отделены двумя и более переходными состояниями. [6]
Весьма нестрогое определение, под которым, как правило, понимают такое химическое превращение, когда для перехода реагентов в продукты необходимо преодолеть только одно переходное состояние. Элементарная реакция может быть моно -, би - и значительно реже тримолекулярной. При этом порядок и молекулярность совпадают. Элементарная реакция характеризуется соответствующей элементарной константой скорости реакции. Отсюда следует: химическая реакция, которая включает две и более элементарные реакции, является многостадийной химической реакцией. В этом случае реагенты от продуктов отделены двумя и более переходными состояниями. [7]
Под термином ПС подразумевается состояние сближения реагентов, соответствующее вершине потенциального барьера ( точка минимакса), на пути перехода реагентов в продукты по поверхности потенциальной энергии. [8]
Закон сохранения массы находит свое объяснение в том, что при течении химической реакции происходит только перегруппировка атомов ( при переходе реагентов в продукты), а число атомов и масса каждого атома остаются постоянными. Если же число атомов каждого элемента, а следовательно, их общая масса не изменяются, то и масса реагентов должна всегда быть равной массе продуктов. [9]
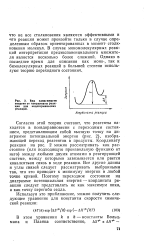 |
Вид зависимости энергии от координаты реакции для эндотермических реакций. [10] |
Согласно этой теории считают, что реагенты находятся в псевдоравновесии с переходным состоянием, представляющим собой высшую точку на диаграмме потенциальной энергии ( рис. 2), изображающей переход реагентов в продукты. Координату реакции на рис. 2 можно рассматривать как расстояние ( или подходящую произвольную функцию от него) между любыми двумя атомами в реагирующей системе, между которыми завязывается или рвется ковалентная связь в ходе реакции. Все другие длины и углы связей следует рассматривать выбранными так, что это приводит к минимуму энергии в любой точке кривой. Поэтому переходное состояние на диаграмме потенциальная энергия - координата реакции следует представлять не как максимум пика, а как точку перегиба седла. [11]
Второй разновидностью циклических реакций являются каталитические. Их особенность в том, что переход реагента в активную форму происходит не в результате термического, фотохимического или иного воздействия, а при взаимодействии реагента с вводимым веществом-катализатором. [12]
В соответствии с этим образование большей части Hg происходит во второй фазе реакции. При еще большем различии kl и k2 возможным становится первоначальный, почти полный, переход реагентов в промежуточное вещество и последующее, отделенное во времени от первой стадии, превращение промежуточного вещества в продукты реакции. [13]
При последующей обработке полученных кинетических зависимостей c P / U от времени важно обратить внимание па долю низкокипящего реагента, находящегося в газовой фазе. Если она не превышает 5 %, что гарантировано при значениях Ж1500 ( мм рт. ст. - л) / моль, переходом низкокипящего реагента из газовой фазы в жидкую ( или наоборот) Б ходе реакции можно пренебречь. В нротишюм случае в полученные значения кинетических констант необходимо вносить поправки, учитывающие этот переход. [14]
Применение истода флеш-фотолиза связано с применением вспышки света, действующей в течение короткого времени на начальной стадии фотолиза. Состав реакционной смеси затем контролируют спектроскопически например, по поглощению в ультрафиолетовой или видимой областях спектра или по магштгому резонансу), при этом наблюдают1 переход возбужденных реагентов в стабильные продукты. [15]
Страницы: 1 2