Переход - твердая фаза
Cтраница 3
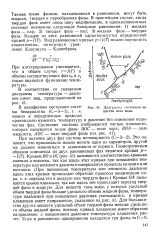 |
Диаграмма состояния вещества типа воды. [31] |
Это означает, что произвольно можно менять один из параметров, другой же должен изменяться в зависимости от пер-вого. Кривые ВО и ОС ( рис. 41) называются соответственно кривыми кипения и возгонки, так как вдоль этих кривых при повышении температуры или внешнего давления совершаются процессы кипения или возгонки. Кривая О А называется кривой плавления, так как вдоль нее происходит переход твердой фазы в жидкую. Для веществ типа воды, у которых удельный объем твердой фазы больше удельного объема жидкой фазы, температура плавления при повышении давления уменьшается, и кривая плавления имеет направление, указанное на рис. 41, Для большинства других веществ удельный объем твердой фазы меньше удельного объема жидкой фазы, поэтому кривая плавления имеет обратное направление: с повышением давления температура плавления растет. [32]
Рассмотрим этот вопрос сначала с энергетической стороны. Если наблюдать процесс плавления и отвердевания кристаллических и аморфных тел, то можно заметить, что кристаллические тела имеют точку плавления, при которой вещество находится в устойчивом состоянии в обеих фазах - в твердой и в жидкой, аморфные же тела постепенно размягчаясь при нагревании, не имеют определенной температуры, соответствующей переходу твердой фазы в жидкую. [33]
На рис. 1.6 приведена фазовая диаграмма для нормального вещества в координатах р, v, на которой показаны области существования отдельных фаз. Области перехода одной фазы в другую являются двухфазными областями. Каждая из таких областей ограничена пограничными линиями. При этом, если для области парообразования имеется критическая точка, для перехода твердой фазы в жидкую критической точки нет или, по крайней мере, она экспериментально не обнаружена, несмотря на то, что опыты проводились до очень высоких давлений. [34]
Страницы: 1 2 3