Переход - хлор
Cтраница 1
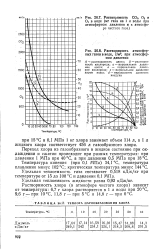 |
Растворимость СО2, 02 и О3 в воде ( мг газа на 1 л воды при атмосферном давлении и в атмосфере чистого газа.| Растворимость атмосферных газов в воде, г / м3, при атмосферном давлении. [1] |
Переход хлора из газообразного в жидкое состояние при охлаждении и сжатии происходит при разных температурах: при давлении 1 МПа при 40 С, а при давлении 0 5 МПа при 18 С. [2]
По мере перехода хлора из газовой фазы в жидкую концентрация его в газовой смеси все время снижается, а концентрация примесей ( водород, воздух и двуокись углерода) соответственно возрастает. Как только начинается сжижение, концентрация хлора падает, снижается и его парциальное давление при постоянных давлении и температуре процесса. Поэтому для полного ( 100 % - ного) сжижения всего хлора, содержащегося в исходном хлоргазе, его нужно охладить до очень низкой температуры или при постоянной температуре процесса значительно повысить давление. Так, в нашем примере, чтобы перевести в жидкую фазу 99 % хлора, исходный хлоргаз необходимо охлаждать до - 40 С, и все же концентрация хлора в газовой смеси при этой температуре будет 17 объемн. [3]
Говоря о переходе хлора из состояния А в состояние Г, можно сказать, что он отдает восемь электронов, при переходе от В к Г - шесть электронов, от Б к Г - семь электронов. Наоборот, при переходе от Г к В каждый атом хлора присоединяет шесть электронов, от Г к Б - семь электронов, от Г к А - восемь электронов. Вещество, в состав которого входит элемент, присоединяющий электроны, называется окислителем; вещество, содержащее элемент, отдающий электроны, - восстановителем. [4]
Говоря о переходе хлора из состояния А в состояние Г, можно сказать, что он отдает восемь электронов, при переходе от В к Г - шесть электронов, от Б к Г - семь электронов. [5]
Говоря о переходе хлора из состояния А в состояние Г, можно сказать, что он отдает восемь электронов, при переходе от В к Г - шесть электронов, от Б к Г - семь электронов. Наоборот, при переходе от Г к В каждый атом хлора присоединяет шесть электронов, от Г к Б - - семь электронов, от Г к А - восемь электронов. Вещество, в состав которого входит элемент, присоединяющий электроны, называется окислителем; вещество, содержащее элемент, отдающий электроны, - восстановителем. [6]
Говоря о переходе хлора из состояния А в состояние Г, можно сказать, что он отдает восемь электронов, при переходе от В к Г - шесть электронов, от Б к Г - семь электронов. Наоборот, при переходе от Г к В каждый хлор присоединяет шесть электронов, от Г к Б - семь электронов, от Г к Л - восемь электронов. Вещество, в состав которого входит элемент, присоединяющий электроны, называется окислителем; вещество, содержащее элемент, отдающий электроны - восстановителем. [7]
Говоря о переходе хлора из состояния А в состояние Г, можно сказать, что он отдает восемь электронов, при переходе от В к Г - шесть электронов, от Б к Г - семь электронов. Наоборот, при переходе от Г к В каждый хлор присоединяет шесть электронов, от Г к Б - семь электронов, от Г к А - восемь элейл тронов. [8]
При варке рабочих электролитов этиленгликоль всегда нагревается и в него добавляется аммиак; поэтому становится возможным переход связанного хлора в ионное состояние. [9]
При варке рабочих электролитов этиленгликоль всегда нагревается и в него добавляется аммиак; поэтому становится возможным переход связанного хлора в ионное состояние. Такие переходы возможны также и в самом рабочем электролите в готовых конденсаторах при эксплуатации их в условиях повышенной температуры окружающей среды. [10]
Интересно отметить, что фтор, находящийся в кольце, не мигрирует в условиях, когда происходят переходы хлора или брома от одного углерода к другому. По-видимому, в процессе миграции галоген должен приобретать некоторый положительный заряд, что невозможно для фтора. [11]
Нами предложен метод количественного определения хлорацетальдегида, основанный на его взаимодействии с гид-разинсульфатом при комнатной температуре [-5], приводящему к количественному переходу связанного хлора в ионное состояние. Хлор-ион может быть определен по методу Фоль-гарда либо другим объемным или весовым методом. [12]
Недостатками парового метода являются нерациональность его применения для обесхлоривания стоков, содержащих значительные количества активного хлора, в связи с переходом хлора в хлориты, сброс которых недопустим; продолжительность процесса и энергоемкость, обусловленная большими затратами тепла я а отпаривание. [13]
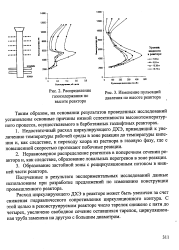 |
Изменение пульсаций давления по высоте реактора. [14] |
Недостаточный расход циркулирующего ДХЭ, приводящий к увеличению температуры рабочей среды в зоне реакции до температуры кипения и, как следствие, к переходу хлора из раствора в газовую фазу, где с повышенной скоростью протекают побочные реакции. [15]
Страницы: 1 2