Перинафтенон
Cтраница 1
Перинафтенон ( 130) дает две волны равной высоты, являющиеся, согласно величинам 1Л, одноэлектронными. [1]
Перинафтенон не способен к диеновым конденсациям, а его 8-карбоновая кислота ( XIX), являющаяся циклическим аналогом метиленацетоуксусной кислоты, при кипячении ( 3 час. [2]
Перинафтенон образует оксим при действии гидроксиламина 20, а при действии перекиси водорода - окись в результате присоединения по двойной связи, соседней с карбонилом. [3]
Перинафтенон XXXIX обнаруживает заметную тенденцию к образованию альтернантных ароматических систем. [4]
Перинафтенон II может быть получен также из хлорангидрида нафтилпрошюновой кислоты. Циклизация нафтилпрошюнилхло-рида III под действием хлористого алюминия приводит сначала к дигидроперинафтенону IV, дегидрирование которого дает 4 пери-нафтенон II. Безводная фтористоводородная кислота может быть использована для конденсации нафтола с акролеином 6, также приводящей к перинафтенону. [5]
Сплавление перинафтенона I с цинковой пылью дает с низкими выходами триметиленнафталин и перопирен III. Образование перо-пирена может быть объяснено возникновением промежуточного продукта II в результате восстановительной конденсации, наблюдавшейся для ненасыщенных кетонов Ч Лучшие результаты получены при предварительной обработке перинафтенона I цинковой пылью в растворе едкого натра. [6]
На полярограмме перинафтенона в буферном растворе в широком интервале рН имеется две одноэлектронные волны. [7]
Аналогично ведут себя при восстановлении перинафтенон [67, 150], 2-формил - и 2-ацетилпирролы [187, 1479], 3-формил -, 3-ацетил -, 3-бутирил - и 3-бензоилпирролы [187, 1129], 4-оксо - 1 2 3 4-тетрагидрохинолин [1090], спиро - ( циклопен-тан-1 2 -индолин) - 3 -он [715, 716], 2-метил - 2 - ( 2 -метил - 3 -индолил) - индоксил [717], а также производные акридона 188 ], ксантона, тиоксантона [189, 1486] и некоторых других соединений [190, 1409, 1490], которые подвергаются гидрогенолизу ( частичному или полному) до соответствующих дезоксидигидросоединений. Диметил-5 - ацетоаце-тилпиррол вопреки ожиданиям восстановился до 2 4-ди-метил - 5-бутирилпиррола. [8]
По своим свойствам очень близок к тропону перинафтенон. [9]
Скелет бензантрона может быть построен, исходя из системы перинафтенона. [10]
Аналогичные соединения ( XLI, R ацил) получены при взаимодействии перинафтенона с ацилхлоридами. Если эти соединения обработать цинковой пылью или активированным магнием в эфире, образуются темно-синие растворы, которые могут быть хромато-графированы и освобождены от исходных веществ и примесей. Синие растворы, полученные при взаимодействии перинафтенона XXXIX, ацетилхлорида и магния, имеют полосы поглощения при 6130, 3330, 3170, 3050, 2400 А. Синяя окраска ослабевает при охлаждении и возвращается при нагревании. Она необратимо исчезает при кипячении в результате образования перопирена ( см. стр. [11]
Дальнейшее окисление 6в приводит к 1 8-перинафтенон - 4 5-дикарбоновой кислоте LXIV, дающей при декарбоксилировании перинафтенон LXV, и нафталин-1 4 5 8-тетра-карбоновой кислоте LXVI. Позднее было показано, что получаемый пиренхинон является смесью двух хинонов, которые могут быть разделены в виде диацетатов соответствующих диоксипиренов. [12]
С), растворяется в концентрированной серной кислоте, давая желтый раствор с интенсивной зеленой флуоресценцией, а также в концентрированной соляной кислоте, из которой осаждается при разбавлении. Нагревание перинафтенона со спиртовым едким кали дает перопиренхинон ( см. стр. [13]
Перинафтен синтезирован лишь недавно. Гидразон перинафтенона разлагается 31 с образованием перпнафтена при нагревании с кристаллическим едким натром в вакууме при 130 - 140 С. [14]
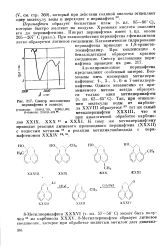 |
Спектр поглощения перинафтена в этаноле. [15] |
Страницы: 1 2