Больший период
Cтраница 2
Большим периодом обычно называют величину d - K / 2Q, где К - длина волны, а 20 - угол дифракции, соответствующий максимуму в распределении интенсивности малоуглового рассеяния рентгеновских лучей. Изучение больших периодов, в частности при различных температурах [1], представляет большой интерес, поскольку оно позволяет судить о различиях в степени порядка в структуре полимеров. Съемки рентгенограмме больших углах показали, что степень ориентации кристаллитов в волокнах была весьма высокой и практически не менялась после проведения температурных съемок, поскольку волокна в образце находились в натянутом состоянии. [16]
Элементы больших периодов, у которых очередные электроны размещаются не на внешнем энергетическом уровне, а на d - поду-ровне второго снаружи уровня, Д. И. Менделеев расположил в побочных подгруппах периодической системы. Следовательно, к элементам главных подгрупп относятся те элементы, в которых очередные электроны размещаются на s - и / - подуровнях наружного энергетического уровня. [17]
Для больших периодов времени справедлива схема квазистационарного переноса компонента в пределах блока. Здесь так же предполагается, что продольный перенос в проводящих каналах осуществляется только конвективным путем, а обмен между каналами и блоками диффузионным и конвективным путем. [18]
Элементы больших периодов подгруппы III A являются по своему строению аналогами алюминия. Существует, однако, принципиальное отличие химии галлия, индия и таллия от химии алюминия: возможность устойчивого существования соединений этих элементов со степенью окисления 1, которая не характерна для алюминия. Современное объяснение такой особенности основано на концепции инертной пары s - электронов и уменьшении прочности связей нижних членов групп. Для рассмотрения надо привлечь особенность электронного состояния II группы, где появляющаяся Я52 - электронная пара имеет довольно устойчивый характер и с трудом поддается отщеплению. Так, ртуть, несмотря на то, что это жидкий металл, окисляется с трудом из-за высокого потенциала ионизации ( 10, 43 эВ) 6з2 - орбитали. Трудность возбуждения второго и третьего электронов у галлия, индия и таллия становится еще больше. [19]
В больших периодах закономерное изменение характера элементов и радиусов их атомов ( слева направо по периодам или наоборот) происходит более плавно, чем в малых периодах, что приводит к так называемой горизонтальной аналогии некоторых элементов, являющихся близкими соседями по этим периодам. [20]
В больших периодах в ряду элементов d - семейства уменьшение радиусов атомов менее интенсивно, чем в рядах s - и р-элементов. [21]
В больших периодах не все свойства элементов изменяются так последовательно, как во втором и третьем. Здесь наблюдается еще некоторая периодичность в изменении свойств внутри самих периодов. Так, высшая валентность по кислороду вначале равномерно растет при переходе от одного элемента к другому, но затем, достигнув максимума в середине периода, падает до двух, после чего опять возрастает до семи к концу периода. [22]
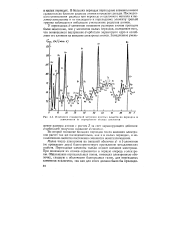 |
Изменение стандартной энтропии простых веществ по периодам в зависимости от порядкового номера элементов. [23] |
В больших периодах переходные элементы имеют сравнительно близкие радиусы атомов в пределах декады. После резкого уменьшения радиуса при переходе от щелочного металла к ще-лочно-земельному и от последнего к переходному элементу третьей группы наблюдается небольшое уменьшение радиусов атомов. [24]
В больших периодах переход от ионных нитридов к ковалентным осуществляется через металлоподобные нитриды d - элементов, у которых наблюдается наложение ионной, ковалентной и металлической связи. Благодаря участию в связях между атомами металлов и азота s -; p - и d - электронов химическая связь в таких нитридах очень прочна. [25]
В больших периодах оказывается восемнадцать групп и элементы побочных подгрупп отделены от элементов соответствующих главных подгрупп. В этом заключаются как преимущество, так и недостаток длиннопериодной формы. Родство элементов побочных подгрупп с элементами соответствующих главных подгрупп в длиннопериодной форме устанавливается тем, что соответствующим подгруппам придаются одинаковые номера, только с разными индексами - главным А, а побочным В. Таким образом обозначаются шестнадцать групп, а группы кобальта и никеля или оставляют вообще без номера, или присоединяют их к группе железа, придавая всем трем группам номер VIIIB. В длиннопериодной форме, хотя и устраняются противоречия, связанные с совмещением элементов главных и побочных подгрупп, однако противоречия правилам изменений свойств элементов в некоторых рядах и группах остаются. Помимо этих противоречий, в длинной форме периодической системы отсутствует симметрия расположения элементов, особенно при разделении их на металлические и неметаллические, а также имеются разрывы в малых периодах, которые нарушают наши представления о непрерывности изменения свойств элементов. [26]
В больших периодах отдача и принятие электронов в общем происходят так же, как и в малых, с той лишь разницей, что металлические свойства ослабевают гораздо медленнее, так как в них происходит пополнение электронами не последнего электронного слоя, а предпоследнего, а у лантаноидов и актиноидов, расположенных в 6 - м и 7 - м периодах, - даже третьего энергетического уровня, считая от внешнего. Поэтому в 4 - м периоде все элементы первой половины периода имеют на внешнем уровне 2 ( реже 1) электрона и характеризуются преобладанием металлических свойств. [27]
В больших периодах отдача и принятие электронов в общем происходят так же, как и в малых, с той лишь разницей, что металлические свойства ослабевают гораздо медленнее, так как в них происходит пополнение электронами не последнего электронного слоя, а предпоследнего, а у лантаноидов и актиноидов, расположенных в 6 - м и 7 - м периодах, - даже третьего энергетического уровня, считая от внешнего. Поэтому в 4 - м периоде все элементы первой половины периода имеют на внешнем уровне два ( реже один) электрона и характеризуются преобладанием металлических свойств. [28]
 |
Периодическая зависимость теплот образования окислов от атомного номера катиона. [29] |
В больших периодах имеются по два максимума теплот образования окислов. Они отделены минимумами, приходящимися на окислы меди, серебра и золота, от максимумов для элементов главных II или III подгрупп. Максимумы здесь соответствуют окислам цинка, галлия, индия и таллия - элементов III группы, которые более электроположительны, чем лежащие справа от них кова-лентно-металлические и ковалентные элементы главных IV-VIII подгрупп. Кадмий и ртуть образуют окислы с меньшим выделением тепла, чем индий и таллий. Максимумы для ZnO - Ga203, IngOs и Т1203 соответствуют первичной периодичности элементов главных подгрупп с заполняющимися р-подоболочками. Таким образом, в 4 - м и 5 - м периодах имеет место двойная периодичность свойств. [30]
Страницы: 1 2 3 4