Перкарбонат
Cтраница 3
Систематические данные о влиянии условий на образование перкарбонатов также не были получены. [31]
Это соединение обладает всеми преимуществами перборатов и перкарбонатов и подобно пирофосфату натрия способно удалять следы ионов металлов и дефлокулировать и эмульгировать грязь. Его формула Na4P2O7 - 2H2OL, и оно содержит 9 % активного кислорода. Подобные персоли являются слабыми окислителями и пригодны для отбеливания шерсти, найлона и ацетатных волокон, но действуют они довольно медленно. [32]
Это соединение обладает всеми преимуществами перборатов и перкарбонатов и подобно пирофосфату натрия способно удалять следы ионов металлов и дефлокулировать и эмульгировать грязь. Его формула i Ta4P2O7 2Н2О, и оно содержит 9 % активного кислорода. Подобные персоли являются слабыми окислителями и пригодны для отбеливания шерсти, найлона и ацетатных волокон, но действуют они довольно медленно. [33]
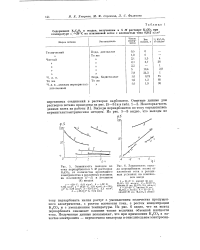
Из рис. 6 видно, что на выход перкарбоната оказывает влияние также величина объемной плотности тока. [35]
На основе этих данных разработан новый способ получения истинных перкарбонатов ( пероксокарбонатов) щелочных металлов, заключающийся в карбонизации водных щелочных растворов перекиси водорода. [36]
Последняя дает те же самые реакции, как и перкарбонат калия, найденный Констамом и Ганзеном. [37]
Как и у пербората, стабильность порошка и раствора перкарбоната падает с повышением температуры. На нее неблагоприятно влияют следы железа, меди, марганца и свинца, которые разлагают и перборат. Далее устойчивость перкарбоната в порошке снижается в присутствии влаги. [38]
Из других перекисных соединений можно упомянуть о перфосфатах и перкарбонатах, которые могут быть получены окислением на аноде соответственно фосфатов и карбонатов. [39]
Надугольная кислота неизвестна в свободном состоянии; ее соли ( перкарбонаты) в водном растворе нестойки, но распадаются уже при комнатной температуре на корбонаты и перекись водорода. [40]
Также электролитически из крепких растворов К2СО3 при сильном охлаждении получается перкарбонат, который в растворе легко отщепляет перекись водорода. [41]
Свободная надутольная кислота неизвестна; напротив, надутлекислый калий ( перкарбонат калия) КзСЮв оказывается веществом вполне стойким в сухом состоянии. [42]
Свободная надутольная кислота неизвестна; напротив, надутлекислый калий ( перкарбонат калия) КзСЮс оказывается веществом вполне стойким в сухом состоянии. [43]
Кроме того, некоторое место было отведено изучению физико-химических свойств перкарбонатов, полученных нами, так как в литературе свойства этого класса соединений освещены очень слабо. [44]
Однако сомнительно, чтобы эти соединения явля; лись бы истинными перкарбонатами. Они представляют собой исключительно гигроскопичные вещества, относительно стойкие лишь при хранении в эксикаторе. [45]
Страницы: 1 2 3 4