Перманга-нат - калий
Cтраница 1
Перманга-нат калия может окислять хлорид-ион, и применения его в случае использования солянокислых растворов следует избегать. [1]
Кислые растворы перманга-ната калия нельзя сохранять, так как они разлагаются быстрее нейтральных растворов. [2]
Аналогичным образом нагревают перманга-нат калия. [3]
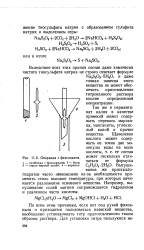 |
Операции с фиксаналом. [4] |
Так же и перманга-нат калия в качестве примесей может содержать перекись марганца, манганиты, углекислый калий и прочие вещества. [5]
Медленно титруют раствором перманга-ната калия, применяя сильно подкисленный раствор хлорида железа ( III) в качестве внешнего индикатора. [6]
В качестве катализатора применяется перманга-нат калия в количестве 0 25 %, который вводится в расплавленный парафин при 130 С в виде горячего водного раствора; вода испаряется и катализатор остается в виде тонкой дисперсии в реакционной массе. Для этой цели готовится 10 % - ный раствор КМп04 при 120 - 150 С. [7]
Марганцовокислый калий, или перманга-нат калия, КМпО4 имеет наибольшее применение среди всех соединений марганца. [8]
Методика установления нормальности раствора перманга-ната калия следующая На аналитических весах берут 3 - 4 навески оксалата натрия. Размер навески выбирается таким, чтобы на титрование ее расходовалось около 20 мл раствора перман-ганата калия. С каждой навеской проводят следующие операции. Перед титрованием раствор навески оксалата натрия нагревают до 70 - 90, но не до кипения и титруют раствором перманганата калия до появления не исчезающей розовой окраски раствора от одной капли раствора перманганата калия. В начале титрования реакция между пер-манганатом калия и оксалатом натрия идет медленно, поэтому и необходимо нагревание. В дальнейшем реакция между пер-манганатом калия и оксалатом натрия идет быстро, практически мгновенно. Зная величину навески Na2C2O4 и объем раствора КМпО4, затраченный на титрование, вычисляют значения нормальности раствора ( см. уравнение ( 36) на стр. [9]
Окись азота окисляют раствором перманга-ната калия до двуокиси азота. Определение заканчивают колориметрическим методом, основанным на реакции с метафенилен-диамином с образованием желто-коричневой окраски, или по реакции с сульфаниловой кислотой и а-нафтиламином в уксуснокислом растворе с образованием розово-красной окраски. [10]
Сильные окислители ( например, перманга-нат калия) при комнатной температуре тоже не действуют на алканы. [11]
Так, например, раствор перманга-ната калия ( КМпО4) или хромовая смесь ( K2Cr2O7 H2SO4) при комнатной температуре не окисляют предельные углеводороды и при контакте с ними не изменяют свою окраску. [12]
Если слить подкисленные эквимолярные растворы перманга-ната калия, имеющего красно-фиолетовую окраску, и нитрита натрия, то через некоторое время реакционная смесь обесцвечивается. [13]
Одним из наиболее распространенных титрантов является перманга-нат калия, поскольку он сам представляет собой индикатор. [14]
Рассмотрим в качестве примера процесс облучения перманга-ната калия нейтронами. Энергия отдачи атомов 66Мп составляет 300 эв. [15]
Страницы: 1 2 3 4