Перманганат - натрий
Cтраница 2
Если неорганические перекисные соединения при соблюдении определенных условий поддаются количественному определению при помощи перманганата натрия, треххлористого титана или йодистого калия, то в случае органических перекисей это не всегда ИМ еет место. В частности, в случае а л кил перекисей таким путем удается определить лишь 80 % содержащегося и них активного кислорода. [16]
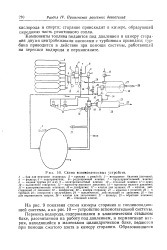 |
Схема вспомогательных устройств. [17] |
Перекись водорода, содержащаяся в эллиптическом стальном баке, рассчитанном на работу под давлением, и перманганат натрия, находящийся в маленьком цилиндрическом баке, подаются при помощи сжатого азота в камеру сгорания. [18]
Перманганат натрия ( тригидрат NaMnO4 - 3H20) намного легче растворяется, но труднее кристаллизуется. Перманганат кальция Са ( МпО4) 2 - 5Н2О также легко растворяется в воде, он тоже находит применение. [19]
Перманганат калия ограниченно растворим в воде ( 7 г в 100 г раствора при 25); в связи с этим часто приходится работать с большими объемами. Лучше растворимый перманганат натрия слишком гигроскопичен, а перманганат кальция окисляет настолько энергично, что иногда вызывает воспламенение окисляемого вещества. [20]
Так, перхлорат аммония с 3 % окиси меди начинал гореть лишь при давлениях выше 135 ат, а с 3 % окиси хрома - выше 230 ат; скорости горения при этом были значительно меньше, чем у перхлората с хромитом меди. Окислы железа и марганца, а также перманганат натрия уменьшали скорость горения перхлората аммония при 100, 150 и 200 ат соответственно и увеличивали - при более высоких давлениях. [21]
В результате прибавления перманганата калия удаляются окрашенные примеси, которые в противном случае остаются до конца при последующих перегонках кислоты. Возможно, что целесообразнее применять концентрированный раствор перманганата натрия, который очень хорошо растворим в воде, однако в этом случае трудно обнаружить конец реакции. [22]
Электрохимические способы получения пермангана-тов основаны на анодном растворении марганцевых сплавов. Особый интерес этот способ приобретает для получения перманганата натрия, поскольку его получение по комбинированному способу сопряжено с рядом технологических трудностей. [23]
В результате прибавления перманганата калия удаляются окрашенные примеси, которые в противном случае остаются до конца при последующих перегонках кислоты. Возможно, что целесообразнее применять концентрированный раствор перманганата натрия, который очень хорошо растворим в воде, однако в этом случае трудно обнаружить конец реакции. [24]
Обычно для этого используют ферромарганец или силикомарганец, которые дешевле металлического марганца и менее склонны к анодной пассивации. Этот способ может быть также применен для получения перманганатов натрия, аммония, лития, бария и некоторых других, получение которых первым способом встречает ряд трудностей. [25]
Источником энергии для катапульты служило разложение перекиси водорода раствором перманганата натрия или перманганата кальция. [26]
Окисление неорганических и органических соединений широко используется в промышленной практике при переработке и обезвреживании отходов. Для очистки сточных вод применяются следующие окислители: хлор и его соединения, перманганат натрия, бихромат калия, кислород воздуха, озон, перекись водорода и др. Выбор окислителя определяется экономическими показателями и зависит от количества и состава сточных вод, наличия окислителей и требуемой степени очистки. Применение перманга-ната и бихромата калия, нитрита и нитрата натрия нецелесообразно - усложняется технологическая схема вследствие необходимости удалять избыток окислителей и продуктов их восстановления. [27]
Окисление меркаптола происходит в железном цилиндре с мешалкой и рубашкой для охлаждения водой и обогрева паром. В нем смешивают 800 л воды со 120 кг 25 % - ной уксусной кислоты и 100 кг перманганата натрия. При постоянном перемешивании и охлаждении вносят 50 кг меркаптола, распределенные порциями на 6 час. После третьего часа мешалку на время останавливают и / прибавляют еще 40 кг 25 % - ной уксусной кислоты и 50 кг перманганага, потом опять пускают в ход мешалку на 12 часов. [28]
При одновременном впрыске в реакционную камеру пергидроля и концентрированного раствора перманганата происходит реакция с выделением кислорода, причем образуется окись марганца, близкая по составу к МпО2 и действующая в качестве катализатора распада. Поскольку здесь используются растворы с высокой концентрацией ионов перманганата, то пришлось отказаться от перманганата калия, который плохо растворяется, и применять перманганаты натрия или кальция, либо их смеси. [29]
Перманганат натрия, марганцовокислый натрий, NaMnO4 ЗН2О вследствие технич. Способы получения в общих чертах сводятся к нагреванию МпОа со смесью едкого натра с бертолетовой солью или селитрой и к извлечению смеси май-ганата и перманганата натрия водой. Обычно смесь манганата и перманганата натрия приготовляют, сплавляя МпО2 с каустич. Перманганат натрия - расплывчатые, легко растворимые п воде кристаллы; по своим свойствам он очень похож на перманганат калия и может применяться в тех же случаях, как и последний. Однако трудность получения в чистом виде препятствует его технич. [30]
Страницы: 1 2 3