Пероксид
Cтраница 2
Пероксид ( перекись) водорода представляет собой бесцветную сиропообразную жидкость плотностью 1 45 г / см3, затвердевающую при - 0 48 С. [16]
Пероксиды и надпероксиды щелочных металлов являются сильными окислителями. Горючие вещества ( алюминиевый порошок, древесные опилки и др.), будучи смешанными с Na2O2, дают яркую вспышку при поджигании. [17]
Пероксид натр ия - еще более сильный окислитель - применяют при щелочном сплавлении. [18]
Пероксиды ( перекиси) типа Э3О3 известны для лития и натрия. Твердые, термически устойчивые вещества. [19]
Пероксиды и супероксиды щелочных металлов - сильные окислители, активно ( иногда со взрывом) взаимодействуют с порошкообразными металлами, углем и фосфором, применяются для изготовления запалов. [20]
Пероксиды, особенности строения которых обусловливают цисоидное расположение заместителей к пероксидной группе, характеризуются более высоким значением дипольного момента. [21]
Пероксид ( перекись) водорода представляет собой бесцветную сиропообразную жидкость плотностью 1 45 г / см3, затвердевающую при - 0 48 С. [22]
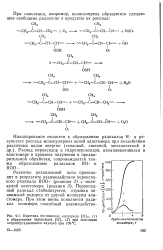 |
Кинетика поглощения кислорода [ О ] св ( 1 и образования пероксидов [ О ] ( 2 при окислении натрийбутадиенового каучука при 100 С. [23] |
Пероксид - о ный радикал стабилизуется, отрывая подвижный водород от другой молекулы эластомера. [24]
Пероксиды активно действуют на эластомеры. Они вызывают процессы деструкции или сшивания эластомера ( см. гл. Эффективность реакций возрастает в присутствии таких катализаторов, как соли металлов переменной валентности, а также восстановителей, способных к образованию с пероксидами окислительно-восстановительной системы. Окислительное действие Н2О2 проявляется, например, при введении его в натуральный латекс. Присутствующая в латексе сернистая кислота ускоряет распад пероксида водорода, вызывая окисление и деструкцию латекса, после коагуляции которого получается пластичный каучук, не требующий заводской пластикации. [25]
Пероксиды со сложными органическими радикалами могут претерпевать ступенчатый распад. [26]
Пероксиды могут возникать и накапливаться в ряде производств органического синтеза, в частности в производствах бутадиенового и хлоропренового каучука, фенола и ацетилена, при самопроизвольном окислении органических веществ. Чаще всего пероксиды образуются при длительном хранении веществ, склонных к образованию таких соединений, и в различного рода застойных местах технологического оборудования и коммуникаций. [27]
Пероксид трет-бутила количественно не определяется. Реакцию пероксида лауроила с иодид-ионом ведут в безводной среде - смеси ледяной уксусной кислоты и хлороформа ( для ускорения анализа) - и только затем вводят воду и фоновый электролит и завершают анализ. [28]
Пероксиды органические, нестойкие взрывоопасные ( взрывчатые), легковоспламеняемые вещества, являющиеся производными перокси-дами водорода, в которых один или оба водородных атома замещены органическими радикалами. Неустойчивость обусловлена пероксидной группой - О-О -, которую содержат эти вещества. В мягких условиях пероксиды могут реагировать аналогично соответствующим кислородсодержащим пероксидным соединениям, причем пероксидная группа остается незатронутой. В более жестких условиях, при повышенной температуре, в присутствии концентрированной серной кислоты или катализаторов пероксидная связь разрывается, и молекула расщепляется на несколько свободных радикалов или ионов. Разложение обычно экзотермично и в большой массе может протекать со взрывной скоростью. [29]
Пероксиды являются окислителями, при контакте с легковоспламеняемыми веществами может произойти воспламенение. Большинство пероксидов легко возгорается от искры, пламени и других источников зажигания и сгорает с большой скоростью. В больших массах возможен переход горения во взрыв. Органические пероксиды чувствительны к трению и удару. При затвердевании чувствительность повышается, поэтому жидкие пероксиды не следует хранить при температуре ниже точки их плавления. Органические пероксиды весьма нестабильны при хранении; в сосудах при комнатной температуре они постепенно разлагаются; разложение приводит к образованию различных газообразных продуктов: диоксида углерода, свободного кислорода, низших алифатических углеводородов и др. Скорость разложения определяется природой пероксида, присутствием каталитических загрязнений, воздействием солнечного света, особенно ультрафиолетовых лучей, и резко возрастает с повышением температуры. [30]
Страницы: 1 2 3 4