Пероксид - плутоний
Cтраница 1
Пероксид плутония осаждается как из кислых сред ( азотно -, соляно - и сернокислых), так и из ацетатно-оксалатных-и карбонатных растворов. [1]
Пероксид плутония ( IV), имеющий общую формулу А-1-х 2 - ЗЕЬО ( А - анион неорганической кислоты), представляет собой светло-зеленый коллоидный ( при осаждении в определенных условиях - мелкокристаллический) хорошо отстаивающийся осадок, в котором отношение перекисного кислорода к плутонию равно трем или больше трех. При осаждении пероксида из сульфатных, хлоридных или нитратных растворов в осадке обнаруживается соответствующий ион неорганической кислоты, причем отношение SC42 -: Pu, как правило, составляет 0 3: 1; СГ: Ри - около 0 5: 1; а М0з -: Ри колеблется в широких пределах. При высушивании пероксид-ных осадков происходит их частичное или полное разложение. [2]
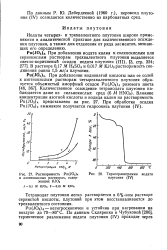 |
Растворимость Ри ( Юз 4 в азотнокислых растворах, содержащих KJO3.| Термогравиграмма иодата плутония ( IV. [3] |
По данным Р. Ю. Дебердеевой ( 1960 г.), пероксид плутония ( IV) осаждается количественно из карбонатных сред. [4]
Металлический плутоний получают методом, начальной операцией которого является осаждение пероксида Плутония из нитратных растворов для очистки и выделения плутония. Хотя, как правило, получают отличный выход плутония в осадок ( при осаждении 300 г пероксида плутония из 2 5 M HN03 потери за счет растворимости ее превышают 0 1 %), при этом должны контролироваться такие факторы, как кислотность, валентность плутония и наличие примесей, катализирующих процесс разложения пероксида. [5]
Сначала появляется красно-коричневая окраска ( вследствие образования растворимой пероксосоли плутония), а затем осаждается оливково-зеленый пероксид плутония. Осадок центрифугируют, трижды промывают 15 % - ным пероксидом водорода. Фильтрат и промывные воды сохраняют для регенерации плутония. Пероксид плутония легко растворяется в конц. [6]
Метод [ 294а ] основан на измерении светопоглощения перо-ксидного комплекса титана при 410 ммк после отделения раствора от осадка пероксида плутония. [7]
Так, имеется качественное доказательство комплексообразования плутония ( IV) с с у л ь-ф и т-и оном. Пероксид плутония ( IV) легко растворяется в водном растворе сульфита аммония при комнатной температуре. Спектрофотометрические наблюдения показывают, что существует по меньшей мере два сульфитных комплекса и что SO - ион является более сильным комплексообразователем, чем ионы С1 - и SOj, но более слабым, чем карбонат и цитрат. Качественное доказательство цитратного компле к с ообразования плутония ( IV) получено при ионообменных исследованиях. В 0 05 М растворе лимонная кислота-цитрат при рН 2 примерно 50 % плутония ( IV) находится в виде комплексных анионов. Прибавление ацетата к раствору плутония ( IV) вызывает изменение его окраски: от коричнево-зеленого до пурпурно-оранжевого. Из растворов с концентрацией ацетатного комплекса плутония ( IV) более 0 1 М выпадает розовая основная соль. Существование отрицательно заряженных ацетатных комплексов обнаружено электромиграционным методом, а изменения спектра поглощения плутония ( IV) при добавлении ацетата в дальнейшем подтвердили образование таких комплексных ионов. Образование карбонатных комплексов плутония ( IV) установлено чисто качественно. [8]
Растворимость пероксида в воде составляет десятые доли миллиграмма плутония на литр раствора, а в слабокислых растворах 5 - 10 мг / л плутония. Пероксид плутония легко растворяется в кислых растворах в присутствии окислителей или восстановителей, разрушающих перекись водорода. Прокаливание пероксида приводит к образованию двуокиси плутония. [9]
При добавлении перекиси водорода к кислому ( 1 - 3 М Н) раствору плутония ( III), плутония ( IV) или плутония ( VI) выпадает зеленый осадок, который в насыщенном растворе иногда - бывает красно-коричневым. Осадок представляет собой пероксид плутония ( растворимые пероксидные комплексы плутония обсуждаются ниже, в разд. Уран и нептуний в четырехвалентном состоянии при добавлении перекиси водорода также образуют нерастворимые осадки, однако эти соединения, по-видимому, являются производными шестивалентного состояния, а не четырехвалентного. Пероксид урана имеет состав U04 - 2H2O, тогда как в настоящее время известно, что осадок пероксида тория, которому одно время приписывали формулу Th207, включает анионы. В этом отношении пероксид плутония более похож на пероксид тория, чем урана. Исследование показало, что в пероксиде плутоний находится в четырехвалентном состоянии. При осаждении пероксида из растворов серной, азотной или соляной кислот осадок пероксида содержит значительные количества соответствующего аниона. [10]
Если для осаждения пероксида плутония ( IV) применять большой избыток Н2О2, то влияние кислотности ( в интервале 0 4 - 4 М) на полноту осаждения плутония незначительно. Шестивалентный плутоний не осаждается перекисью водорода, но восстанавливается ею до четырехвалентного состояния. Однако процесс восстановления протекает медленно. Поэтому, если плутоний частично находится в виде Pu ( VI), то осаждение его будет неполным. [11]
Наименее загрязненную двуокись плутония с составом, почти отвечающим стехиометрии, получают при прокаливании пе-роксида плутония и оксалатов трех - и четырехвалентного плутония [ 3, стр. Прокаливание высушенных кристаллических оксалатов плутония ( III) и ( IV) и пероксида плутония ( IV) производят при медленном повышении температуры от 25 до 700 С. Для предотвращения распыления осадка вследствие идущих одновременно процессов обезвоживания и разложения пероксид плутония ( IV) необходимо нагревать в интервале температур от 90 - 200 С особенно осторожно. Сульфат-ион, входящий в структуру пероксида плутония ( IV), улетучивается в виде 5Оз при 600 - 700 С. Оксалаты плутония следует прокаливать при температуре не ниже 900 - 950 С. Как уже отмечалось, для получения двуокиси плутония стехиометрического состава во всех случаях прокаливание проводят при 1050 - 1200 С. [12]
Металлический плутоний получают методом, начальной операцией которого является осаждение пероксида Плутония из нитратных растворов для очистки и выделения плутония. Хотя, как правило, получают отличный выход плутония в осадок ( при осаждении 300 г пероксида плутония из 2 5 M HN03 потери за счет растворимости ее превышают 0 1 %), при этом должны контролироваться такие факторы, как кислотность, валентность плутония и наличие примесей, катализирующих процесс разложения пероксида. [13]
Для отделения плутония от урана предложено ( Ф. П. Кондрашова, 1953 г.; Р. Ю. Де-бердеева, 1960 г.) осаждение пероксида плутония ( IV) из карбонатных растворов. Из полученного раствора плутоний осаждают перекисью водорода. Время отстаивания осадка составляет - 20 час. Остаточная концентрация плутония в этих условиях выражается величиной, вполне удовлетворяющей требованиям весового анализа, хотя, по-видимому, равновесное состояние в растворе даже за 24 часа еще не достигается. [14]
Низший, коричневый комплекс [ Ри-О - О-Ри - ОН ] 5 образуется при малых концентрациях Н2О2 и содержит два атома плутония на одну перекисную группу. Следует учитывать, что перекись водорода в зависимости от условий реакции может действовать как окислитель и как восстановитель, окисляя Pu ( III), восстанавливая Pu ( IV) и Pu ( VI), а также способна осаждать пероксид плутония ( IV), когда ее концентрация достаточно высока. В сйязи с этим истинные равновесия в растворах очень сложны [ 3, стр. [15]
Страницы: 1 2