Перрената
Cтраница 1
Перренаты менее устойчивы в щелочных и значительно более устойчивы в кислых растворах. Рениевая кислота HReO4 довольно сильная кислота н она значительно более устойчива, чем марганцовая кислота. Она растворяет гидроокиси, например А1 ( ОН) з, выделяет СО из карбонатов и растворяет металлы, выделяя водород. Водный раствор ReaOs реагирует подобно перекиси. [1]
Перренаты, перманга-наты, иодаты, хлооистая ртуть ( I), хлористое олово ( IV) и хлористый цинк также образуют нерастворимые комплексы и будут мешать открытию перхлората. [2]
Перренаты менее устойчивы в щелочных и значительно более устойчивы в кислых растворах. Рениевая кислота HReO4 довольно сильная кислота н она значительно более устойчива, чем марганцовая кислота. Она растворяет гидроокиси, например А1 ( ОН) з, выделяет СО из карбонатов и растворяет металлы, выделяя водород. Водный раствор ReaOs реагирует подобно перекиси. [3]
Перренаты, перманга-наты, иодаты, хлооистая ртуть ( I), хлористое олово ( IV) и хлористый цинк также образуют нерастворимые комплексы и будут мешать открытию перхлората. [4]
Перренаты более устойчивы, чем перманганаты, степень окисления рения в них понижается только под действием сильных восстановителей. [5]
Перренаты проявляют значительно меньшие окислительные свойства, чем перманганаты. [6]
Перренаты являются прочными солями, подобно перхлоратам, и все растворимы в воде. Однако соли калия, рубидия, цезия и таллия мало растворимы. Перренаты с гексамминкобальтинитратом образуют характерный золотисто-коричневый кристаллический осадок. [7]
Перренаты ( ион ReO) дают ряд реакций, аналогичных реакциям на МпО4 - и С1О -, а именно: они образуют кристаллические осадки с солями калия, рубидия, цезия ( рис. 299), серебра и таллия, а также с нитроном ( иглы, пучки игл), с метиленовой синей ( темносиние иглы с желтым и фиолетово-красным дихроизмом), с бруцином ( бесцветные иглы и призмы), со стрихнином и акридином. [8]
Перренаты полностью ионизованы в этом растворителе. По-видимому, экстракция марганца, рения и теллура в семивалентных состояниях из 4 М раствора едкого натрия пиридином 52 также связана с экстракцией щелочных солей. [9]
Перренаты Na, Mg, Ca и Си ( II) хорошо растворяются в воде, а перренаты К, Rb, Cs и Ag - плохо. [10]
Перренаты Na, Mg, Ca и Си ( И) хорошо растворяются в воде, а перренаты К, Rb, Cs и Ag - плохо. [11]
Перренаты типа K [ Re04I весьма устойчивы как по отношению к нагреванию, так и по отношению к восстановителям. [12]
Перренаты типа KfReOJ весьма устойчивы как по отношению к нагреванию, так и по отношению к восстановителям. [13]
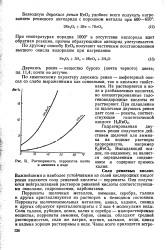 |
Растворимость перренатов калия и аммония в воде. [14] |
Перренаты щелочных металлов, аммония, серебра, таллия и других кристаллизуются из растворов в безводном состоянии. Перренаты щелочноземельных металлов, цинка, кадмия, свинца и других образуют кристаллогидраты с 2 или 4 молекулами воды. Соли таллия, рубидия, цезия, калия и серебра - малорастворимые вещества; перренаты аммония, бария, свинца, обладают средней растворимостью, соли же натрия, магния, кальция, меди, цинка н кадмия хорошо растворимы в воде. [15]
Страницы: 1 2 3 4