Перфосфат
Cтраница 1
Перфосфаты отличаются от известных в большом количестве пероксигидратов различных фосфатов ( например, Na2HP04 - H202 - пероксигидрат кислого фосфорнокислого натрия) некоторыми характерными для них реакциями, например окислением Мп до MnOJ. От над-фосфорной кислоты она отличается тем, что вызывает, как и ЩС, желтое окрашивание раствора сульфата титана, однако она не дает, подобно перекиси водорода, реакции образования надхромовой кислоты. [1]
Перфосфат бария ВагР2Ов - 4НгО получабтея из раствор перфосфата калия и хлористого бария, Эца соль представ вляет собой белое мелкокристаллическое Вещество, плохо р рймое в йоде, легче растворимое в уксусной кислоте и в азотной и соляной. [2]
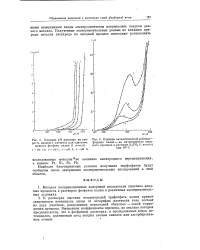
Гидролиз перфосфатов протекает легче, чем гидролиз персульфатов. [3]
Далее, перфосфаты образуются при действии фтора на водные растворы динатрийфосфатэ и пирофосфата натрия. [4]
Изучение окислительно-восстановительных процессов ( перфосфаты), Отч. [5]
Наиболее благоприятные условия получения перфосфатов будут сообщены после завершения экспериментальных исследований в этой области. [7]
Из других перекисных соединений можно упомянуть о перфосфатах и перкарбонатах, которые могут быть получены окислением на аноде соответственно фосфатов и карбонатов. [8]
К персолям относятся перборат и перкарбонат натрия, перфосфат натрия и персульфат калия. Лучшим является перборат натрия. Наличие в нем бора кроме белизны придает белью очень эффектный блеск. Но в связи с тем что персоли обладают сильной щелочностью, применять их следует в основном только для белья из хлопчатобумажных и льняных тканей. [9]
Перфосфат бария ВагР2Ов - 4НгО получабтея из раствор перфосфата калия и хлористого бария, Эца соль представ вляет собой белое мелкокристаллическое Вещество, плохо р рймое в йоде, легче растворимое в уксусной кислоте и в азотной и соляной. [10]
Иначе происходит разложение в Н2018 - гораздо медленнее гидролизующегося перфосфата. Оно дает кислород, состав которого зависит от рН раствора. [11]
Таким образом, при гидролизе перкарбоната, пербората и перфосфата перекисная группа О-О переходит, не разрушаясь, в образующуюся Н20а так, как ранее было найдено [1] для гидролиза персульфата. [12]
Наряду с истинными адфосфорпьши кислотами и их солями - перфосфатами - - существует ряд других соединений, содержащих активный кислород в виде кристаллогидроперекиси. Их следует называть пергидратамй фосфатов. Часто оба вида соединений неправильно обозначают одним термином псрфосфаты, нес митры на их большое конституционное различие. В этом разделе будут рассмотрены лишь истинные перфосфаты. [13]
Результаты этих исследований показали, что многие полученные чисто химическим путем перкарбонаты и перфосфаты, а также продажный перборат являются продуктами молекулярного присоединения и, далее, что существует ряд органических и неорганических соединений, в которых перекись водорода способна замещать кристаллизационную воду или присоединяться наряду с последней. [14]
Во второй главе рассмотрены электрохимические методы синтеза надсер-ной кислоты, персульфатов, перборатов, перфосфатов, озона, гидразина. Третья глава содержит описание процессов электросинтеза перманганата калия, двуокиси марганца, окислов меди, ртути, свинца, кислородных соединений хрома. В четвертой главе описаны катодные процессы электролиза гидр-оксиламина, дитионита натрия, перекиси водорода, кислородных соединений хрома и урана, а также рассмотрена возможность применения электролиза в синтезе аммиака. [15]
Страницы: 1 2 3